CMDE审评论坛官方发布IVD共性问题答疑汇总(二)
4.
关于体外诊断试剂临床试验检测结果不一致样本的确认 (2017-11-02)
5.
关于体外诊断试剂临床试验对比试剂/方法的选择 (2017-11-02)
6.
如何统计体外诊断试剂定量检测产品临床试验数据 (2017-11-02)
7.
关于体外诊断试剂临床试验入组病例样本的常见问题 (2017-11-02)
8.
欧盟体外诊断新法规主要变化情况简介 (2017-11-02)
9.
人EGFR突变基因检测试剂注册申报现状及共性问题概述 (2017-11-03)
10.
海洛因滥用的特异性检测物:6-单乙酰吗啡 (2017-11-15)
11.
选择体外诊断试剂临床试验机构除法规要求资质外还应考虑的因素有哪些 (2017-11-15)
12.
在60℃条件下进行了终产品的加速稳定性试验,是否可以不限定产品的储运条件 (2017-11-15)
13.
产品货架有效期缩短,是否不需在许可事项变更申请中再提交技术文件 (2017-12-05)
14.
FoundationOne CDx伴随诊断产品概述 (2017-12-21)
4. 关于体外诊断试剂临床试验检测结果不一致样本的确认 (2017-11-02)
临床试验方案中应明确试验用体外诊断试剂和对比试剂检测结果不一致样本的判定依据,对临床试验中判定为检测结果不一致的样本应采用“金标准”或其他合理的方法进行复核,方案中应明确用于复核的“金标准”或方法。临床试验报告中应给出最终确认的结果或判定,如无需复核,应详细说明理由。
5. 关于体外诊断试剂临床试验对比试剂/方法的选择 (2017-11-02)
依据《体外诊断试剂临床试验技术指导原则》规定,对于新研制体外诊断试剂,采用试验用体外诊断试剂与诊断该疾病的“金标准”进行盲法同步比较;对于“已有同品种批准上市”的产品,可选择已上市产品作为对比试剂。
应充分了解所选择产品/方法的技术信息及性能,如方法学、临床预期用途、主要性能指标、校准品的溯源情况、阳性判断值或参考区间等,充分考虑对比试剂/方法与试验用体外诊断试剂的可比性,选择适当的对比试剂/方法进行试验,以便通过比对验证试验用体外诊断试剂的临床性能。
6. 如何统计体外诊断试剂定量检测产品临床试验数据 (2017-11-02)
对于定量检测产品,其临床试验结果应依据产品的检测性能选择回归分析等适宜的统计分析方法,在合理的置信区间,考察两种试剂结果是否呈显著相关性,定量值结果是否存在显著统计学差异。如有可能,建议应考虑到在不同的样本浓度区间试剂的性能可能存在的差异,对总体浓度范围进行区间分层统计,对不同浓度区间内的结果进行相关性分析以更好的验证两种试剂的相关性。
7. 关于体外诊断试剂临床试验入组病例样本的常见问题 (2017-11-02)
1. 关于入组病例要求
临床试验中的临床样本是指按照临床试验方案进行入组的病例,所有入组病例应唯一且可溯源,病例入组应涵盖产品预期用途及干扰因素,充分考虑产品临床使用过程中声称的适应症及可能存在的干扰因素。临床样本应尽可能使用前瞻性样本,如有必要可使用部分回顾性样本,但同样应能够对病例进行溯源,并建议在临床试验方案中说明使用回顾性样本的理由。
2. 关于总体样本例数要求
临床样本的总体例数应符合《体外诊断试剂临床试验技术指导原则》的基本要求。其中阳性样本、阴性样本及干扰样本的分布应能够满足各临床机构分别统计及总体统计的要求,能够充分验证产品的临床性能,产品的预期用途应得到有效验证。
3. 关于联检产品样本例数要求
对于多项联检产品,如多项毒品检测试剂,其临床样本应能够满足每项待测物的总样本数均符合《体外诊断试剂临床试验技术指导原则》的要求,且样本分布合理,能够对该项检测进行统计分析并验证其临床性能。
4. 关于多位点基因突变检测产品样本例数要求
对于多位点基因突变检测的产品,其临床总样本例数应符合《体外诊断试剂临床试验技术指导原则》的要求,其中每个型别阳性样本、阴性样本例数均应满足统计学意义,应能充分验证各型别检测的临床性能。对于其中临床罕见型别,其临床样本中阳性样本可酌情减少,但应确保一定例数进行较充分的临床性能验证。
5. 关于用于罕见病检测的体外诊断试剂的临床减免
用于罕见病检测的体外诊断试剂产品,临床阳性样本可酌情减免,临床总阳性样本数应具有统计学意义。
6. 关于临床样本类型的要求
样本类型应与说明书声称一致,对于涵盖不同样本类型的情况,如果产品声称的不同样本类型具有可比性,如血清、血浆,应以一种样本类型为主,样本量满足《体外诊断试剂临床试验技术指导原则》要求进行临床试验,同时增加其他类型样本与上述样本比对的临床试验,比对样本例数应满足第三类产品至少为200例、第二类产品至少为100例的要求,并在至少2家(含2家)临床试验机构开展临床试验;如不同的样本类型不具有可比性,一种样本类型样本量满足《体外诊断试剂临床试验技术指导原则》要求,其余样本类型与对比试剂同样进行样本比对,每种样本类型与上述情况相比酌情增加。
8. 欧盟体外诊断新法规主要变化情况简介(2017-11-02)
2017年5月5日, 欧盟官方期刊(Official Journal of the
EuropeanUnion)正式发布了欧盟体外诊断医疗器械法规(IVDR,EU 2017/746)。2017年5月25日,IVDR 正式生效,体外诊断医疗器械指令(IVDD,98/79/EC)被体外诊断医疗器械法规取代。IVDR 从几个方面对原有IVDD框架进行了修订与完善,如定义与概念、各方职责与义务、风险分类管理、符合性评估流程、公告机构的指定与管理、产品性能评估和性能研究、加强市场监管要求等。IVDR 法规共九章113 条,并附有15个附录。
一、关于法规过渡期
法规过渡期为5年,共涉及四个时间点(见表1):
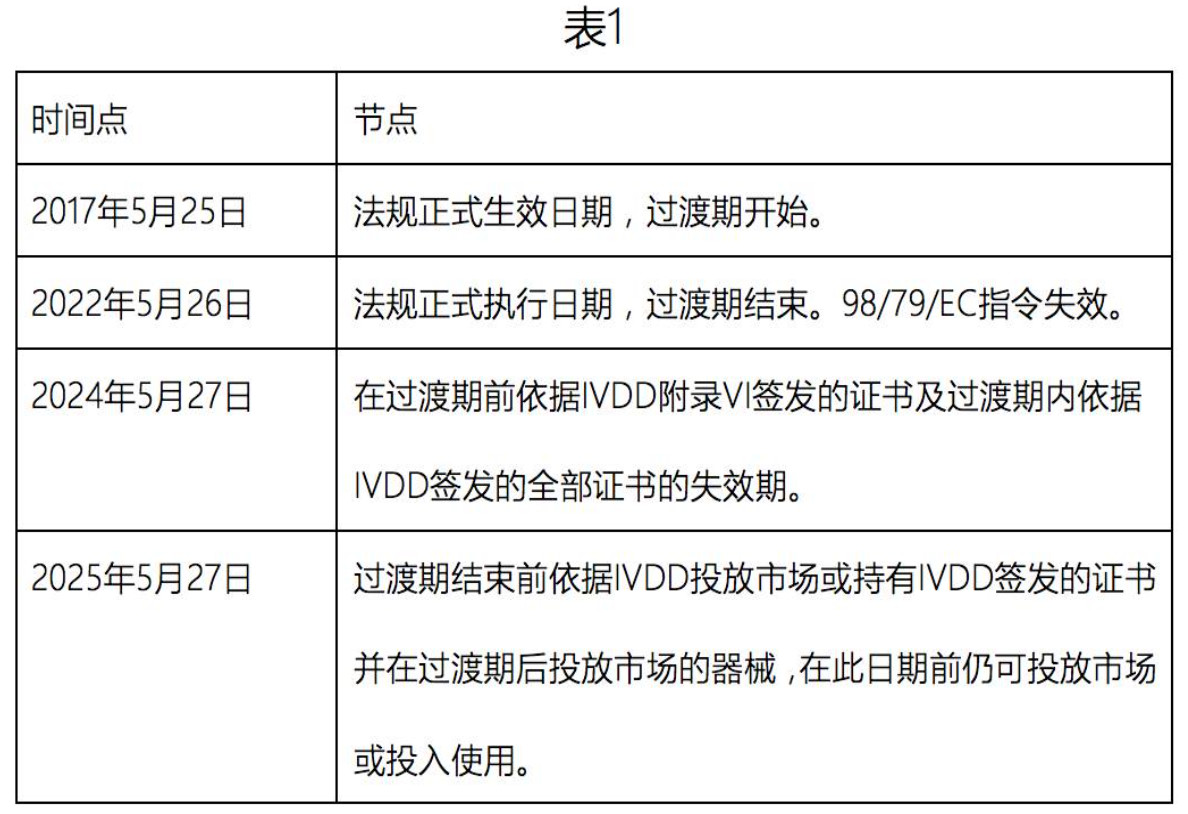
过渡期结束后,所有体外诊断器械必须满足IVDR 的要求,即自2022年5月26日起,公告机构依据IVDD 发布的任何通知将失效。
在2017年5月25日之前, 公告机构根据IVDD 签发的证书在证书所示期限到期前继续有效,但是根据IVDD 附录VI 签发的证书应在2024年5月27日之前失效。
自2017年5月25日起, 公告机构根据IVDD 签发的证书在2024年5月27日之前失效。仅具有根据IVDD 规定签发的证书的器械可投放市场的前提是自IVDR 适用之日起,其在设计和预期的目的上无显著变化并符合新法规有关市场后监察、市场监察、警戒、经济运营商及器械注册的规定。
在过渡期结束(2022年5月26日)之前,根据IVDD 投放市场的器械及自2022年5月26日起投放市场并具有证书的器械在2025年5月27日之前可继续投放市场或投入使用。
通过IVDD 豁免,符合新法规的器械可在2022年5月26日之前投放市场。并可在2022年5月26日前指定并通知符合新法规的符合性评估机构。公告机构可在2022年5月26日前,采用其规定的符合性评估流程并按照新法规签发证书。
对于高风险产品(需经D 类产品符合性评估流程评估的产品),在已委派必要的医疗器械协调小组(MDCG)、专家小组和欧盟参考实验室前提下,同样可通过IVDD 豁免在2022年5月26日之前投放市场。
制造商需在过渡期内更新技术文件和流程以满足新法规更严格的要求。
二、关于公告机构
整体来讲, 欧盟新法规对公告机构的管理是以成员国主管机构为主体组织实施,欧盟理事会、欧盟级别的专家理事会参与并监管的模式开展的对公告机构的评估,并在委任后实施持续监管、持续审核的管理。
欧盟新法规对于公告机构的管理更为严格,所有公告机构需要获得欧盟主管当局的认可后,才能依据IVDR进行审核。一般公告机构都会在过渡期内维持IVDD 的审核资质。只要公告机构具有IVDD 的审核资质,可以申请认证。资质证书的有效期是有限的。
三、产品分类的变化
IVDD
基于清单分类(list-basedsystem),将产品分为List A,ListB 和其他。而IVDR 基于规则分类(rule-based classification system),将产品按照风险等级分成A 类(最低风险),B 类,C 类和D 类( 最高风险)。与IVDD的清单分类相比,IVDR 的规则分类更为复杂。产品的风险等级是由产品的预期用途和被测量的分析物决定的,和产品的命名无关。如果产品适用多个分类,则应遵循最高分类原则。
如D类包含:(1)检测血液、血液成分、细胞、组织或器官、或其任何衍生物是否存在或显露传染性因子,以评估它们是否适用于输血、器官移植或细胞给药;(2)检测是否存在或显露传染性因子,其会导致危及生命的疾病,并且具有高的或可疑的高传播风险;(3)确定危及生命的疾病的、其监控对于患者管理的过程十分关键的病原体载量;(4)用于血型分型或组织分型中的ABO 系统、Rh 系统、KELL 系统、KIDD 系统及DUFFY 系统的器械。D类均为高风险产品。C 类则包括具有较高风险的器械,如用以确保用于输血或移植或细胞给药的血液、血液成分、细胞、组织或器官具有免疫相容性的其他血型分型或组织分型器械,以及用于检测是否存在或显露性传播病原体的器械、伴随诊断用器械、新生儿先天性疾病筛查等。A类则相对风险较低,包括适用于相关特定的体外诊断检测流程的一般实验室使用的产品、没有危险特征的附件、缓冲液、洗涤液、一般培养基和组织学染色液等;体外诊断用途专用设备;样品容器。其余未被涵盖的器械归为B类,不具有定量或定性赋值的质控品类器械归类为B类。
产品的分类由制造商负责。如果公告机构对产品分类有疑义,公告机构可向主管当局进行咨询。如果公告机构的主管当局和制造商的主管当局咨询的意见仍不一致,医疗器械协调组(MDCG)将参与边界产品分类的决策。
四、关于符合性评估
基于分类原则的产品风险分类,体现在产品分级监管中。在器械投放市场前,不同类别的产品依照IVDR附录IX到XI的符合性评估流程,进行符合性评估。D类器械的符合性评估有两条途径:
途径一:基于质量管理体系和技术文件评估的符合性评估
包括相关器械全生命周期的质量管理体系评估、监管评估、技术文件评估以及上市后主管机构监督要求。制造商需向公告机构提出申请,评估自己的质量管理体系,进行监管评估以确保制造商充分履行批准后的质量管理体系所规定的义务,并申请进行相关器械技术文件评估,在最后一个器械上市后不迟于10年期限内,制造商或其授权代表应受主管机构监管。
途径二:基于型式检验的符合性评估和基于生产质量保证的符合性评估
EU型式检查是公告机构确定和证明器械(包括其技术文件和相关生命周期过程以及所涵盖的相应代表性器械样品)符合法规相关规定要求的程序。制造商应向公告机构提出申请并提交申报文件,由公告机构进行评估,包括技术文件、数据的评估及检验试验过程。基于生产质量保证的符合性评估包括公告机构对实施批准的医疗器械生产质量管理体系的评估、体系监管评估、所生产器械的验证。
上述两项评估程序均要求制造商或其授权代表在最后一个器械上市至少10年内,保管相应文件。
C类器械的符合性评估较D 类有所简化,主要包括质量管理体系评估、体系监管评估和上市后主管机构监督要求,并且每个同类器械组应评估至少一个典型器械的技术文件。
B类器械的符合性评估与C类相似并更为简化,主要包括质量管理体系评估和上市后主管机构监督要求,并且每个器械类别应评估至少一个典型器械的技术文件。
另外法规中还对自测用器械、伴随诊断器械等符合性评估规定了特殊要求。
公告机构在符合性评估后颁发证书,证书有效期为其列明的期限,不超过五年。经制造商申请,证书的有效期可以延长,但每次延期不超过五年,同时需按照适用的符合性评估流程重新评估。
A类器械制造商在拟定符合IVDR 附录II(技术文件)和附录III(关于上市后监管的技术文件)规定的技术文件后,通过签发EC 符合性声明的形式,声明其产品的符合性。基于现有IVDD 指令,只有约不到20% 的体外诊断产品需要公告机构参与,但在IVDR 法规下,预计将有约超过80% 的体外诊断产品需要公告机构参与。
五、关于上市后监管、警戒和市场监管
作为制造商质量管理体系的组成部分,制造商应采用与风险等级相称并且使用与该器械类型相适应的方式来计划、建立、记录、实施、维护和更新上市后的监管体系。不同分类的产品上市后监管报告要求不同,A类和B类器械的制造商应编制一份上市后监管报告,总结根据上市后监管计划收集的上市后监管数据的分析结果和结论,以及采取任何预防和整改措施的理由和描述。应在必要时对报告进行更新,并应按照相应要求提供给公告机构和主管机构。
C类和D类器械的制造商应编制定期安全性更新报告(PSUR),总结根据上市后监管计划收集的上市后监管数据的分析结果和结论,以及采取任何预防和整改措施的理由和描述。C类和D类器械的制造商应至少每年对PSUR进行更新。PSUR 应属于法规规定技术文件中的一部分。
D类器械的制造商应通过电子系统的方式,并向参与符合性评估的公告机构提交PSUR。公告机构应审查该报告,并将其评估添加到该电子系统中,评估中应包括采取任何措施的细节。PSUR 和公告机构的评估应通过电子系统提供给主管机构。
C类器械制造商应向参与符合性评估的公告机构提交PSUR,并应主管机构要求向其提供报告。
制造商应向主管机构报告严重事件和现场安全整改措施。并对警戒数据进行分析。主管机构应主动参与相关程序,协调评估。
主管机构负有市场监督责任,对器械的符合性特性和性能执行适当的检查,包括酌情审查文件以及基于适当样品的物理或实验室检查。必要时可在欧盟层面评估国家措施是否合理。IVDR 从各个层面对体外诊断医疗器械的监管提出了要求,内容丰富,技术要求如第VI 章,对临床证据、性能评估和性能研究的规定,政策层面如对欧盟成员国之间的协调与合作的要求,对公告机构的管理、对电子系统的要求,对器械唯一标识系统(UDI 系统)等方面的要求,更为详细具体。整体法规趋于更为严格的管理模式,如对制造商的要求、对主管机构职责的明确、对公告机构的管理以及对产品基于风险分类的上市前和上市后管理等。具体IVDR 评审要求的变化将取决于欧盟委员会的指导文件, 这些具体的指导文件尚待发布。
(审评六部 吕允凤供稿)
9. 人EGFR突变基因检测试剂注册申报现状及共性问题概述 (2017-11-03)
1. 前言
人表皮因子生长受体(EGFR)突变基因检测试剂是指基于位点特异荧光-核酸聚合酶链式反应(ARMS-PCR法)、基因测序方法等技术,以EGFR突变基因序列为检测目标,体外检测人体病理组织和/或外周血等样本的体外诊断试剂。人EGFR突变基因是肿瘤个体化靶向治疗分子,目前靶向EGFR突变基因的药物主要有两类:一类是作用于EGFR胞外区的单克隆抗体,阻断EGFR与配体的结合,从而阻断下游信号转导途径;一类是作用于胞内酪氨酸激酶活性区域的小分子酪氨酸激酶抑制剂(TKI),如gefitinib和erlotinib。研究表明EGFR突变基因在多种肿瘤细胞中存在,这些突变基因是肿瘤患者是否对TKI敏感的预测因子且被认为是TKI治疗的有效预测指标。
随着一代EGFR-TKIs治疗药物的使用,也发现了一些可能的耐药突变,如发生在外显子20上的替代突变T790M。针对这些耐药突变,目前也开发了一些新型药物,如针对T790M耐药的新药物等。此外,还有许多类型的突变临床意义尚不明确。
2. 该类产品注册审评现状
在我国依据《体外诊断试剂注册管理办法》,人EGFR突变基因检测试剂属于与人基因检测相关的试剂,按照第三类产品进行管理。在美国FDA,人EGFR突变基因检测试剂被归为体细胞突变基因检测系统,按照上市前审批(PMA)管理。检测人EGFR突变基因的方法学主要有位点特异PCR荧光探针法,基因测序法,数字PCR法等,不同方法学之间在检测性能方面也存在明显差异。
3. 人EGFR突变基因检测试剂申报过程中的共性问题
3.1 产品说明书中预期用途的表述
目前该类产品申报说明书中存在预期用途指向不明确、表述不清晰等问题。申请人需规范预期用途表述形式,结合该类产品临床评价数据与肿瘤个体化诊疗药物联合治疗情况客观描述产品预期用途。依据《体外诊断试剂产品说明书指导原则》要求,预期用途需规范EGFR不同突变基因型别表达形式,明确产品外显子、突变位点、cosmic代码等信息。
申请人需依据自身完成的药物诊疗个体化伴随检测研究工作,注意写明申报产品与个体化肿瘤药物联合临床研究相关信息。介绍EGFR突变基因检测的临床背景,包括检测相关适用人群特征、肿瘤组织类型、适用样本类型、待测靶基因序列特征及选择依据,靶基因及其表达蛋白在恶性肿瘤发生、发展过程中可能起到作用,相关药物或其他治疗技术及其作用机理、与待测突变位点可能存在关系等。
3.2 临床研究相关问题
研究表明,EGFR突变基因被检测人群之间存在种族差异。亚裔人群中非小细胞肺癌患者EGFR突变基因阳性率明显高于高加索人群,但目前我国人群肿瘤突变基因数据库缺乏,申请人进行该试剂注册申报前均需完成我国境内临床研究资料,满足《体外诊断试剂临床试验技术指导原则》要求,且需提供EGFR基因型与肿瘤个体化治疗临床意义相关研究资料。非小细胞肺癌人群中,如申报产品部分可检测基因型未发现存在该类突变基因阳性结果,可能与该部分突变基因在我国人群突变频率较低或总样本人群选择存在偏倚有关。针对该类问题,建议申请人扩大临床样本人群或根据不同突变基因突变频率特点,增加不同地域的临床研究机构,提高这部分突变基因阳性检出率。
3.3 关于检测人外周血样本相关问题
申报产品中最常见的样本类型为中性福尔马林固定石蜡包埋病理组织(病理),且获取肿瘤基因相关信息的主要来源仍是肿瘤病理组织样本。研究结果表明,随着肿瘤细胞的凋亡,肿瘤游离DNA(ctDNA)片段释放到人体血液循环中,通过对外周血肿瘤游离DNA的检测解读,也可以较好地了解肿瘤病情的发展情况以及寻找适合的治疗方案,尤其对于那些无法通过手术取得肿瘤组织或希望在治疗后对病情进行跟踪随访的人群,是一种理想和有效的检测手段。但由于血液游离DNA含量及变异情况会随着肿瘤病情的发展、转移性肿瘤的发生以及用药治疗情况发生实时的变化,外周血检测EGFR突变基因检测结果存在一定的不确定性。两种样本在用于人EGFR-TIK治疗效果也存在差异。
鉴于上述原因,人EGFR突变基因检测试剂如适用于外周血样本检测人群,预期用途需限定为晚期NSCLC患者,且作为不能获取NSCLC组织样本时的补充手段。鉴于病理组织样本和外周血样本中EGFR突变基因比例不同,申报产品需分别对检测外周血样本和病例组织样本进行最低检出限的研究。
3.4 关于适用样本采集储存相关问题
病理组织样本需详细介绍组织学样本类型,包括样本来源及取材要求、组织标本采集厚度、样本处理方式(如组织样本的固定及包埋方式)、肿瘤细胞比例等。在对核酸序列进行检测前,需对用于肿瘤组织突变基因检测的标本进行评估,并富集存在EGFR突变基因的肿瘤细胞用于核酸提取。肿瘤细胞所占比例需达到所用检测方法的要求。
外周血采集后,需通过验证试验规定外周血存放条件以及存放时限及温度设置等,包括采用加入抗核酸降解的采血管要求。样本采集管或保存管中所用的防腐剂、抗凝剂、保护剂等辅助成分不应对基因序列扩增产生干扰。血液通常需要先进行抗凝保存,应关注抗凝剂的选择。申请人需对抗凝剂、防腐剂、保护剂等成分进行验证。
因外周血中ctDNA含量低,为提高EGFR突变基因检出率,在临床允许的情况下推荐增加血浆用量。抽血后延迟血浆分离会导致血细胞裂解,释放出基因组DNA(gDNA)至血浆中;大量增加的gDNA会稀释肿瘤来源的ctDNA,使得突变难以检出。因此在标本采集、运输及储存过程中,防止游离DNA降解是首要考虑因素;其次,也应防止血液中白细胞裂解,避免因野生型DNA增加导致ctDNA中EGFR突变基因无法检测。
3.5 产品研发申报难点
人EGFR突变基因检测试剂联合治疗产品使用,用于指导用药或者预后判断,该类产品属于伴随诊断产品,与治疗药物使用安全有效密切相关。美国FDA曾发布伴随诊断产品指导文件,鼓励申请人同步进行治疗产品与伴随诊断产品研发与上市前申请。我中心鼓励申请人在伴随诊断试剂研发时应充分联合治疗药物对产品进行临床评价。但国内具体开发创新性肿瘤个体化药物的生产企业较少,目前多为国外专利期到期后肿瘤个体化药物的仿制药研究。这也给从事该类体外诊断试剂的生产企业开展创新性肿瘤个体化伴随临床研究带来困难。
4. 小结
人EGFR突变基因检测目前是EGFR-TKIs治疗的重要检测靶点,随着核酸检测技术的发展,如:BEAMing技术、数字PCR、高通量测序技术运用于肿瘤个体化治疗,相关突变基因检测越来越受到临床专家和行业研究人员关注。不同于目前临床常规成熟且推荐的检测技术,新的检测技术如何定位、临床个体化应用与临床个体化研究两者存在差异、临床转化医学研究如何有效转化为临床应用,都将是今后注册审评关注重点。
参考文献:
1.
FDA,In Vitro Companion DiagnosticDevices,Guidance for Industry and Food and
Drug Administration Staff,2014-08-06.
2.《非小细胞肺癌血液EGFR基因突变检测中国专家共识》制定专家组.非小细胞肺癌血液EGFR基因突变检测中国专家共识. 中华医学杂志2015年12月8日第95卷第46期
3.中国医师协会肿瘤医师分会,中国抗癌协会肿瘤临床化疗专业委员会.中国表皮生长因子受体基因敏感突变和间变淋巴瘤激酶融合基因阳性非小细胞肺癌诊断治疗指南(2014版) 中华肿瘤杂志2014年7月第36卷第7期
(审评六部 吴传松供稿)
10. 海洛因滥用的特异性检测物:6-单乙酰吗啡 (2017-11-15)
药物滥用(drug
abuse)是国际上通用的术语,指的是与医疗目的无关地反复大量使用一些具有依赖性或称依赖性潜力的药物,用药者采用自身给药形式,导致精神依赖性和身体依赖性,造成精神混乱和一些异常行为。习惯称药物滥用为“吸毒”。
药物滥用已成为当今全球性的严重社会问题,给个人、家庭和社会带来极大危害性。病人服用此类药物后会逐渐产生耐受性,形成心理依赖,一旦中断用药便会产生一系列戒断症状,使病人难以忍受。另外,吸毒者滥用注射器、针头等还容易造成一系列病原体的感染,例如细菌感染、结核病、艾滋病等等。
对此类药物的分析通常采用病人尿液、血液、唾液样本,应用免疫层析分析等方法进行快速的初步筛选,若需要进一步确认,须选用其他方法,例如气液层析法(GLC),高效液相层析法(HPLC)以及气相-质谱分析法(GC/MS)。GC/MS 被认为是最灵敏、准确的确证化验方法,即金标准。
目前被滥用的依赖性药物主要包括阿片类,其他还有可卡因、大麻、某些中枢兴奋剂、镇静催眠药、致幻剂、挥发性溶剂以及酒精和烟草等。阿片类物质主要包括吗啡、海洛因、可待因等阿片类生物碱,其在体内共同的代谢产物为吗啡,其他代谢产物还包括去甲吗啡、去甲吗啡-3-醚的硫酸盐、吗啡-3,6-二葡萄糖醛酸化物等等。海洛因又称双乙酰吗啡或二乙酰吗啡,俗称“白粉”或“白面儿”,是吗啡的衍生物。海洛因在体内代谢很快,血中半衰期仅为3-9 分钟,经体内酯酶水解为6-单乙酰吗啡(6-monoacetylmorphine/6-acetylmorphine,6-MAM /6-AM),又称O6-单乙酰吗啡。
由于吗啡和可待因无法在体内进行乙酰化形成6-单乙酰吗啡,而海洛因的代谢产物中含有6-单乙酰吗啡,因此美国健康与人类服务部(DHHS) 建议将6-单乙酰吗啡作为海洛因滥用的特异性检测物。6-单乙酰吗啡在体内的半衰期约35 分钟,随后快速代谢成吗啡。滥用海洛因者尿液能测出6-单乙酰吗啡的时间一般在24小时内,吸食后的最佳检测时间为2-8小时。此外有研究表明,海洛因滥用的时间越长、滥用的量越大、末次滥用与取尿检验间隔时间越短,检出海洛因或6-单乙酰吗啡的可能性越大。
6-单乙酰吗啡检测试剂盒通常采用特异性的抗体抗原反应及免疫层析和胶体金标记技术,通过抗体竞争结合6-单乙酰吗啡抗原和尿液中可能含有的被检测物的原理来进行检测。测试时,尿液样本在毛细效应下向上层析。如果是阴性,测试区(T)会出现紫红色条带。如果是阳性,测试区(T)将不会出现紫红色条带。无论被测物是否存在于尿液中,质控区(C)都会出现紫红色条带。6-单乙酰吗啡的最低检出限一般为不低于10ng/mL,美国FDA批准的2个同类产品的最低检出限均为10ng/mL。特异性试验研究中,需对人体样本中的常见干扰物(如胆红素等)、常见处方及非处方药物、其他镇痛麻醉类药物如吗啡、可待因等进行检测,以考察产品的抗干扰能力。临床试验可选择同类上市的产品或参考方法进行对比试验,考察产品的临床性能。
目前,我国的吸毒人员情况复杂,国内毒品来源多元化、毒品种类多样化趋势更加明显,进一步加大了毒品问题治理的复杂性。研制一种性能卓越、准确性与灵敏度高的毒品滥用检测方法已引起人们的极大兴趣。通过对6-单乙酰吗啡的检测,可以初步区分海洛因和其他药物的滥用,该类产品不仅适合于基层中的筛查工作,如在征兵、招工、毒驾检查过程中对受检者进行快速简便的筛查,也对禁毒执法工作的开展有一定帮助。
参考文献:
[1]
彭司勋.药物化学.北京:中国医药科技出版社,2007.135-135
[2]
Cone EJ, Welch P., Mitchell JM, Paul BD.Forensic drug testing for opiates. I.
Detection of 6-AcetylMorphine in urine asan indicator of recent heroin
exposure; drug andassay considerations anddetection times. J. Anal. Toxicol.
1991; 15: 1-7
[3]
Department of Health and Human Services.Notice Of Mandatory Guidelines For
Federal Workplace Drug Testing Programs:Final guidelines. Fed. Register 1994;
110 (June 9):11983.(Revised guidelinesexpected in 2002)
[4]
乔静,杨士云,李咏杰.171 例滥用海洛因者的尿样分析.法医学杂志.2000, 16(4):241-242
(审评六部 解怡 供稿)
11. 选择体外诊断试剂临床试验机构除法规要求资质外还应考虑的因素有哪些 (2017-11-15)
选择体外诊断试剂临床试验机构,除参照法规资质要求外,还应同时关注临床试验机构是否具备开展临床试验的条件和能力。首先,临床试验机构应具备开展相应检测项目的能力,应熟悉拟考核产品相应检测项目,日常开展相应检测。如为新产品新标志物,亦应选择熟悉相应方法或同类其他检测,并常规开展相关疾病诊疗工作的机构开展试验。对机构检测能力的评价应包括实验室条件及人员。其次,所选机构应能收集足够的适应症人群入组进行试验,选择对于产品特定适应症具备相应学科优势的机构开展试验。另外,临床试验机构应能够确保配合注册申报过程,包括进行必要的补充试验,配合临床试验核查等。
12. 在60℃条件下进行了终产品的加速稳定性试验,是否可以不限定产品的储运条件(2017-11-15)
加速稳定性试验是指将某一产品放置在外部应力状态下,通过考察应力状态下的材料退化情况,利用已知的加速因子与退化速率关系,推断产品在正常储存条件下材料退化情况的试验,因此储运条件同货架有效期具有直接相关性,需限定产品的储运条件。
(审评三部 供稿)
13. 产品货架有效期缩短,是否不需在许可事项变更申请中再提交技术文件(2017-12-05)
虽然产品货架有效期缩短后,产品在储存周期内质量发生变化的风险降低,但注册人在申请许可事项变更时,建议提供合理解释和必要的支持性资料,例如完成实时稳定性试验后发现产品货架有效期应缩短,建议提供该实时稳定性试验验证资料。
(审评三部 供稿)
14. FoundationOne
CDx伴随诊断产品概述 (2017-12-21)
美国FoundationOne
CDx(以下简称“F1CDx”)于2017年11月30日由美国FDA批准上市。该产品是第一个基于二代测序的多肿瘤、多位点伴随诊断产品。该产品覆盖了5种肿瘤、涉及17种药物共18种治疗方法。12月18日,FDA公布了该产品的安全有效性数据摘要(SUMMARY OF SAFETY AND EFFECTIVENESS DATA,以下简称“SSED”)1。本文从产品及相关政策方面进行简要介绍。
一、产品基本情况
该产品为基于二代测序的体外伴随诊断检测,仅允许在Foundation Medicine公司进行。整个检测包括试剂、软件、仪器(Illumina的HiSeq 4000平台)和检验的相应规程。该产品针对324个基因进行检测,所检测的突变类型包括替换、插入、缺失、拷贝数变化、基因重排等突变,以及微卫星不稳定性、肿瘤突变负荷检测。适用的样品类型为福尔马林固定石蜡包埋组织样本(FFPE)。所检测伴随诊断基因位点及相应的治疗产品见表1。
表1.F1CDx检测位点及相应的伴随药物
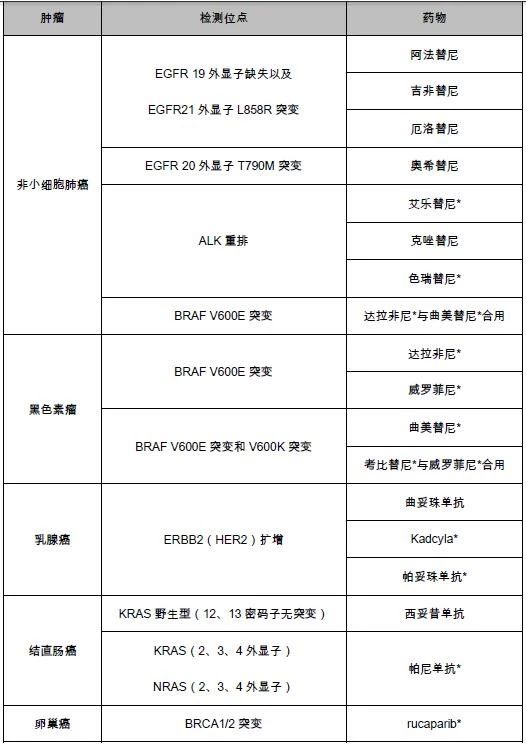
*未在中国上市
F1CDx检测的结论分为三类:
第一类:表1中伴随诊断预期用途的基因情况;
第二类:具有显著临床意义的癌症突变;
第三类:具有潜在临床意义的癌症突变。
美国FDA依据肿瘤个体化基因与癌症关系证据的可靠程度将癌症个体化基因检测试剂分为三级2。F1CDx检测结论的上述分类即符合FDA的分级策略。
第一级:伴随诊断(Companion Diagnostics,CDx)。
伴随诊断试剂要求测试结果所提供的信息足以保证相应治疗药物的安全性和有效性,其预期用途为指导用药。NGS检测的位点应仅包括对药物使用具有明确指导性的位点。这些位点应当通过分析性能评估数据保证其准确性,同时应当通过充分的临床研究保证检测结果与临床病人治疗效果的相关性,或是与之前伴随诊断试剂在临床性能的一致性。
第二级:具有显著临床意义的生物标志物的检测试剂
这一类生物标志物根据专业指南中的相关临床证据显示具有非常显著的临床意义,其预期用途是为专业医护人员提供基于检测结果结合相关临床证据得到与治疗相关的信息。在产品审评中,分析性能评估资料可以是对突变本身的研究资料,或是通过一些具有代表性的研究方法获得的研究资料,临床数据可通过引用公开发表的临床资料证明其临床性能,例如诊疗指南或同等级别的出版物。
第三级:具有潜在临床意义的生物标志物检测试剂
这一类可以定义为除第一级和第二级之外其他肿瘤突变标志物,具有潜在的临床意义。这类产品的预期用途是为可能将要成为临床受试对象的患者提供参考或使用,以判断是否适用相应的试验。其预期用途需要通过分析性能评估数据支持,临床或原理的描述通常使用出版物或者药物体外临床前试验数据为这些位点的意义提供充分的支持。
根据前述美国FDA对于癌症相关基因标志物的分级方式,F1CDx是一个涵盖三级检测基因的体外诊断试剂。F1CDx在向FDA申请上市前为一个实验室自建检测产品(LDT),因此在临床样本收集、数据积累方面有相应的基础。F1CDx的检测结论不仅包括基因的突变情况,同时包括结果的解读、用药指导、患者后续治疗指导等信息3。
二、伴随诊断基因临床研究情况
F1CDx伴随诊断基因临床研究采用与已上市伴随诊断试剂进行等效性研究(Follow-on)4的方式,对产品的临床性能进行了评价。分别从对比试剂、临床样本选择对该产品临床试验进行简要介绍。
(一)对比试剂
此次临床试验进行等效性研究的伴随诊断对比试剂见表2。
表2.F1CDx等效性研究所使用的已上市伴随诊断试剂
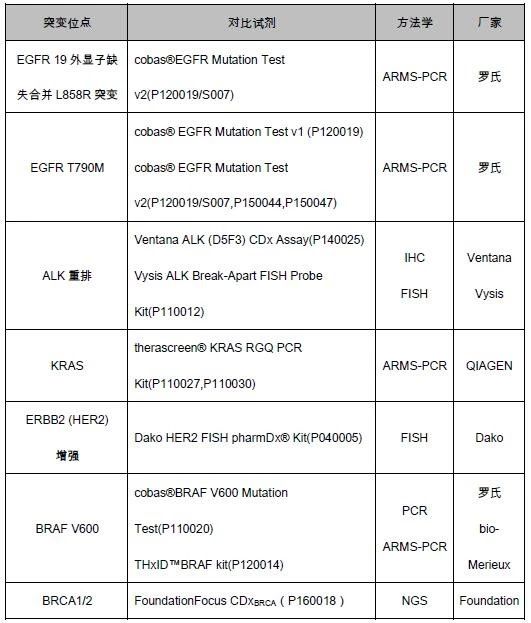
可以看出,在临床对比试剂的选择时并不局限于方法学,此次NGS产品对比方法涵盖了PCR、FISH、IHC、NGS等,主要考虑的是对被测人群筛选的一致性。
(二)临床样本的选择
F1CDx的临床样本的入选及统计学方法主要根据FDA所提出的Follow-On 4伴随诊断试剂研发途径思路进行。
表3.F1CDx临床试验样本情况
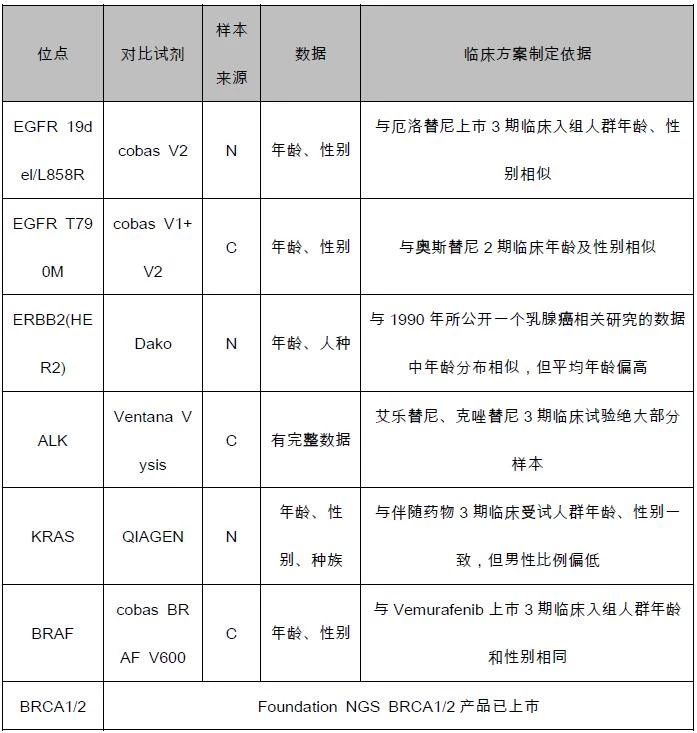
样本来源:C-药物临床试验患者样本;N-非药物临床试验患者样本
此次临床等效性研究使用的临床样本均为不同类型肿瘤患者回顾性组织样本,其中来源于药物临床试验患者样本,考虑回顾性样本检测结果与药物临床研究结果一致性;非药物临床试验这样本,考虑样本的流行病学特征,主要包括年龄、性别、人种等。在伴随诊断试剂的临床研究中,应使入组样本对该试剂的预期使用人群具有代表性。
三、非伴随诊断基因
此次公开的产品SSED中,非伴随诊断目的的324个基因,仅在分析性能评估部分对于一些代表性基因的检测性能进行了验证。对于这些基因是否进行了临床试验并未进行说明。因此应当考虑,基因的测序结果的解读同样应当作为产品的一部分。这与该检测仅能在Foundation Medicine进行的使用范围相一致。
四、关于审批途径
F1CDx是一个涵盖多项肿瘤的检测产品,按EAP特殊路径审批。EAP指用于危及生命或不可逆的疾病或病症的未能满足的医疗需求的快速通道途径。F1CDx通过EAP途径进行审批,基于肿瘤危及生命但尚未被解决的医疗需求。
同时,F1CDx是美国FDA第一个通过“突破性产品”分类途径(BreakThrough Designation,以下简称“突破性途径”)审批上市的IVD产品。“突破性途径”5是2015年美国FDA最初提出的对创新性产品加快审批政策经过不断改进后的上市审批政策,目前仍处于征求意见阶段。进入“突破性途径”后,CDRH会进一步加强与申请人的互动、个性化方案制定及审评优先。
五.小结
基于二代测序的多肿瘤、多位点伴随诊断产品检测结果不仅包含基因突变,同时应当包含对结果分析。美国FDA对于该类产品依然采用基于风险控制的条件性审批,不同检测机构解读能力存在差异,该产品整个检测过程仅能在Foundation Medicine公司进行;同时,美国FDA对该类产品的分级策略更加清晰,伴随诊断相关基因检测依然要求最高,每类突变基因均需要提交临床研究数据支持伴随诊断预期用途;对于该类产品,无论伴随诊断相关突变基因还是该产品其他突变基因,均应充分考虑分析性能,临床研究,结果解读,软件设置,数据库架构等涉及该类产品相关研究资料,以降低该类产品潜在的检测错误和解读错误风险,保证该类产品检测的安全性、有效性。
参考文献:
1. FDA,SUMMARY OF SAFETY
AND EFFECTIVENESS DATA,
http://www.accessdata.fda.gov/cdrh_docs/pdf17/P170019B.pdf,2017.11.30.
2. FDA,CDRH’S APPROACH TO
TUMORPROFILINGNEXT GENERATION SEQUENCINGTESTS,https://www.fda.gov/downloads/medicaldevices/productsandmedicalprocedures/invitrodiagnostics/ucm584603.pdf.2017.11.30.
3. Foundation Medicine,
Sample FoundationONE
CDxReport,https://assets.contentful.com/vhribv12lmne/P1UbtVjOoeAcaOCWoWQkW/ee48a0327bc86d2f0f664168167ccd45/F1CDx_Sample_Report.pdf.
4. Li M. Statistical
Methods for Clinical Validation of Follow-OnCompanion Diagnostic Devices via an
External Concordance Study[J]. Statisticsin Biopharmaceutical Research, 2016,
8(3):355-363.
5. FDA,Expedited Access
for PremarketApproval and De Novo MedicalDevices Intended for Unmet Medical
Needfor Life Threatening or Irreversibly DebilitatingDiseases or Conditions.
2015.4.13.
(审评六部高宇 吴传松 吕允凤 安娟娟供稿)
未完待续。
来源: 奥咨达医疗器械服务集团 临床研究事业部IVD运营部
【本文内容为转载,我公司不对本文所包含内容的准确性、可靠性或者完整性提供任何明示或暗示的保证,不对本文观点负责。如转载内容涉及版权等问题,请立即与我们联系,我们将迅速采取适当措施,以保障双方权益,谢谢。】