申请创新医疗器械的前期准备
时常听说医疗器械中有创新特别审查及创新医疗器械在临床注册及审批中,政策都会给予不少优待。的确,管理部门给到创新类医疗器械的注册开了不少绿灯,但相信大多朋友都还不清楚什么是创新政策及申请创新医疗器械需要准备什么,那我们一起了解吧。
适用范围
适用的条件有三条,分别从来源、前期研究及原理机理来规定:
1. 申请人通过其主导的技术创新活动,在中国依法拥有产品核心技术发明专利权,或者依法通过受让取得在中国发明专利权或其使用权,创新医疗器械特别审查申请时间距专利授权公告日不超过5年;或者核心技术发明专利的申请已由国务院专利行政部门公开,并由国家知识产权局专利检索咨询中心出具检索报告,报告载明产品核心技术方案具备新颖性和创造性。
2. 申请人已完成产品的前期研究并具有基本定型产品,研究过程真实和受控,研究数据完整和可溯源。
3. 产品主要工作原理或者作用机理为国内首创,产品性能或者安全性与同类产品比较有根本性改进,技术上处于国际领先水平,且具有显著的临床应用价值。
递交资料及要求
了解到符合申请条件,就需要准备申请审查的文件资料,主要有以下:
(1)创新医疗器械特别审查申请表;名称应当符合《医疗器械通用名称命名规则》等文件相关规定;
(2)申请人企业资质证明文件;注意境内申请人及境外申请人提交文件的区别;
(3)产品知识产权情况及证明文件;相关知识产权情况证明文件是这部分的重点,主要分已获取中国发明专利权的、依法通过受让取得在中国发明专利使用权的、发明专利申请已由国务院专利行政部门公开、未获得授权这三种情况;
(4)产品研发过程及结果综述;
(5)产品技术文件;至少应当包括:产品的适用范围/预期用途、产品工作原理或者作用机理、明确产品主要技术指标及确定依据;
(6)产品创新的证明性文件,至少应当包括:学术论文、专著及文件综述,已上市同类产品应用情况的分析及对比,产品的创新内容及在临床应用的显著价值;
(7)产品风险分析资料;
(8)产品说明书;
(9)其他证明产品符合《创新医疗器械特别审查程序》第二条的资料;
(10)所提交资料真实性的自我保证声明;
(11)代理人相关资料。
创新器械申请流程
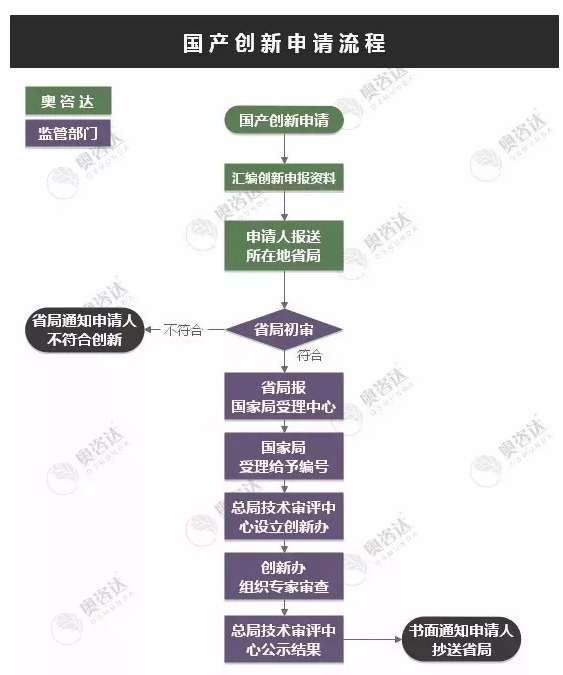
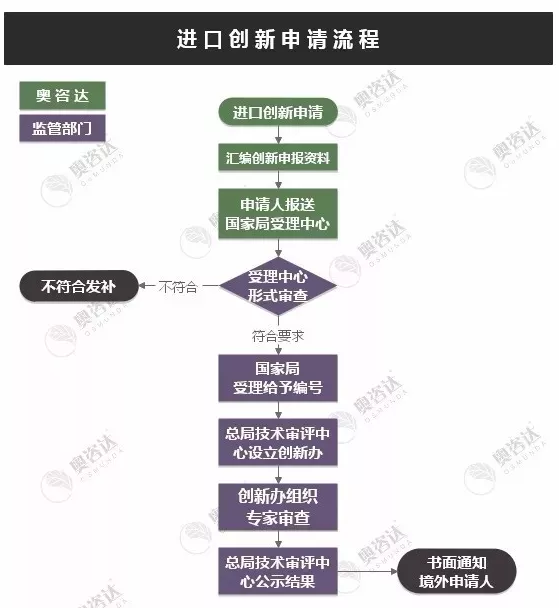
虽然在创新医疗器械在审批流程上有政策扶持,但创新医疗器械在临床试验环节的要求是与其他医疗器械的临床试验的要求无差别,政策激励不等于质量要求门槛减低,这需要医疗器械厂家端正心态。
来源:奥咨达
【本文内容为转载,我公司不对本文所包含内容的准确性、可靠性或者完整性提供任何明示或暗示的保证,不对本文观点负责。如转载内容涉及版权等问题,请立即与我们联系,我们将迅速采取适当措施,以保障双方权益,谢谢。】