新发布:体外诊断试剂产品技术要求与说明书模板
关于发布上海市体外诊断试剂产品技术要求与说明书模板的通知
各相关单位:
为提升注册申报资料规范性,降低体外诊断试剂延续注册发补率,进一步提升审评效率缩短审评时限。上海市药品监督管理局认证审评中心参照《体外诊断试剂说明书编写指导原则》、《医疗器械产品技术要求编写指导原则》组织制定了《体外诊断试剂产品技术要求与说明书模板(试行)》以指导上海市体外诊断试剂申报行政相对人规范产品技术要求与说明书编写格式,现予发布。
特此通知。
上海市食品药品监督管理局认证审评中心
2019年6月25日
相关附件:
1、体外诊断试剂产品技术要求模板(20190603).docx
2、体外诊断试剂说明书基本格式(模板)(20190603).docx
体外诊断试剂产品技术要求模板
本模板按《医疗器械产品技术要求编写指导原则》要求,结合我市体外诊断试剂产品实际情况,以某液体双试剂定量产品为示例编制。注册申请人在制订产品技术要求时,具体指标和方法需根据产品本身特性和相关的国家/行业标准、指导原则拟定。
医疗器械产品技术要求编号:
产品名称
1. 产品规格及其划分说明
试剂1(R1):2×45mL、试剂2(R2):2×15mL;
试剂1(R1):2×45mL、试剂2(R2):2×15mL、校准品:1×2mL;
2×50测试(R1:2×50测试、
R2:2×50测试);
2×50测试(R1:2×50测试、
R2:2×50测试、校准品:1×2mL)
注:测试数标示中各组分的装量应在产品技术要求中明确。
2. 性能指标
2.1试剂性能指标
2.1.1物理性状: R1应为XXX;R2应为XXX。
2.1.2试剂空白:在波长XXXnm附近处,试剂空白吸光度应≤XXXA(光径1.0cm)。
2.1.3精密度
2.1.3.1批内精密度CV≤X%;
2.1.3.2批间相对极差≤X%。
2.1.4准确度:用质控物质(质控品、质控样本、标准物质等定值标物)作样本,其测定结果应在该批质控品规定的范围内。
2.1.5分析灵敏度:测定本试剂盒内所附校准品(XXXmmol/L)(可以为质控品、质控样本、标准物质等定值标物),其吸光度变化值应在XXX~XXXA之间。
2.1.6线性范围:要求试剂盒在样本浓度XXX~XXXXmmol/L范围内:
2.1.6.1线性相关系数r≥XXX ;
2.1.6.2线性相对偏差应在±XXX%的范围内。
2.1.7装量允差:试剂装量应不少于标示量。
2.1.8稳定性:试剂盒在规定的贮存条件下,保存至有效期末,产品的性能应符合2.1.2、2.1.3.1、2.1.4、2.1.5和2.1.6项的要求。
2.2校准品性能指标
2.2.1物理性状:校准品应为XXX。
2.2.2校准品准确度:相对偏差≤X% 。
2.2.3校准品均一性:CV瓶间≤X% 。
2.2.4装量允差:校准品装量应不少于标示量。
2.2.5稳定性:校准品在规定的贮存条件下,保存至有效期末,产品的性能应符合2.2.2项的要求。
注:试剂盒中如含耗材需拟定相应的技术指标并列入产品技术要求。
3. 检验方法
3.1试剂的检验方法
3.1.1物理性状
用目测法检查试剂盒内R1、R2的外观,其结果应符合上述2.1.1项的要求。
3.1.2试剂空白
在主波长XXXnm附近处,比色杯光径为1cm的条件下,以纯化水校零,测定试剂的吸光度,重复两次取平均值,其结果应符合上述2.1.2项的要求。
3.1.3精密度
3.1.3.1批内精密度
取高值、低值两个不同浓度的标本,各测10次或10次以上(n≥10),求取变异系数%(cv%),其结果应符合上述2.1.3.1项的要求。
3.1.3.2批间相对极差
取三批检品,每批取1套,同一标本分别用以上3批检品测定,每套重复测定三次,计算每批检品测定的均值及三批检品测定结果的总均值,三批均值中最大值与最小值之差与总均值的百分比为相对极差,其结果应符合上述2.1.3.2项的要求。
3.1.4准确度
两个不同浓度的质控血清,用试剂盒进行测定,重复三次,取均值,其结果应符合上述2.1.4项的要求。
3.1.5分析灵敏度
在比色杯光径1cm的条件下,测定本试剂盒所附校准品(XXX mmol/L)(此处校准品仅作为满足此项测定要求的已知浓度样本使用)的反应吸光度(经空白试剂校零后取主波长的吸光度值),其结果应符合上述2.1.5项的要求。
3.1.6线性范围
3.1.6.1用线性范围上限附近(±XXX%范围内)的高浓度样本和接近线性范围下限的低浓度样本(或者生理盐水),按下表所示比例混合成X个稀释浓度(Xi)(或者取试剂盒所附校准品,然后用生理盐水按下表所示比例混合成X个稀释浓度(Xi),按标准实验操作步骤进行测定)。分别用试剂盒测定,每个稀释浓度测定1次或1次以上,分别求出测定结果的均值(Yi)。以稀释浓度为自变量,以测定结果均值为因变量求出线性回归方程。按如下的公式计算线性回归的相关系数(r)。所得结果应符合上述2.1.6.1项的要求。
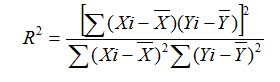 R2开根号,求得r值。
R2开根号,求得r值。
3.1.6.2用3.1.6.1方法中稀释梯度2~6的(xi)代入线性回归方程,计算yi的估计值及yi与估计值的相对偏差或绝对偏差,应符合2.1.6.2项的要求。
3.1.7装量允差取经过校准的量具对试剂量进行检测;产品以测试数作为型号规格的,应在注册检验时检测测试数,其结果应符合上述2.1.7项的要求。
3.1.8稳定性
取在规定的贮存条件下保存至有效期末的试剂盒测试,应符合上述2.1.8项的要求。
3.2校准品的检验方法
3.2.1物理性状
用目测法检查校准品组分的外观,结果应符合2.2.1项要求。
3.2.2校准品的准确度
取工作校准品(溯源链上上级校准品)作为校准品,以产品校准品作为样本进行测定,重复三次,取均值,其结果应符合上述2.2.2项的要求。
3.2.3校准品的均一性
取同一批次待测校准品3瓶或3瓶以上作为样本,用配套试剂测定,每瓶重复测5次或5次以上,求取变异系数%(CV%),结果应符合2.2.3项要求。
3.2.4装量允差
用经过校准的量具对校准品量进行检测,结果符合2.2.4项要求。
3.2.5稳定性
取在规定储存条件下储存至有效期末的校准品测试。结果应符合2.2.5项要求。
4. 术语(如有特别说明的本产品专门术语)
4.1 ……
4.2 ……
……
附录
1 主要原材料 (抗原抗体类原材料需明确生物学来源和接收标准)
R1:
XXX XXXmg/L
鼠抗人xxx抗体I xxxmg/ml 生物学来源:鼠;透明澄清,纯度>XX%,蛋白浓度XXXmg/mL
R2:
XXX XXXmg/L
鼠抗人XXX抗体Ⅱ XXXmg/ml 生物学来源:鼠;透明澄清,纯度>XX%,蛋白浓度XXXmg/mL
校准品:
重组人XXX ≧XXng/ml
透明澄清,蛋白浓度≧XXXng/mL
2 生产工艺
可附《工艺流程图》
3 产品中如包含校准品或质控品,须在相关附录或附件中明确溯源等信息。
注:其它需说明的重要技术问题可以以附录形式进一步明确。
体外诊断试剂说明书基本格式(模板)
本模板按《体外诊断试剂说明书编写指导原则》要求并结合我市体外诊断试剂产品具体情况编制,文中示例仅为参考模板,各企业需根据产品实际情况按要求据实编写产品说明书。
××××(产品通用名称)说明书
【产品名称】
通用名称: 通用名称应当按照《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号)规定的命名原则进行命名,可适当参考相关“分类目录”和/或国家标准及行业标准。
示例:β-羟丁酸测定试剂盒(β-羟丁酸脱氢酶法)
除特殊用途产品可在通用名称中注明样本类型外,其余产品的通用名称中均不应当出现样本类型、定性/定量等内容。
【包装规格】
注明可测试的样本数或装量,如××测试/盒、××人份/盒、××mL,除国际通用计量单位外,其余内容均应采用中文进行表述。如产品有不同组分,可以写明组分名称。如有货号,可增加货号信息。
示例1:
试剂: 2×45mL
示例2:
试剂1(R1):2×45mL、试剂2(R2):2×15mL;
试剂1(R1):2×45mL、试剂2(R2):2×15mL、校准品:1×2mL;
示例3:
2×50测试(R1:2×50测试、 R2:2×50测试);
2×50测试(R1:2×50测试、 R2:2×50测试、校准品:1×2mL)
【预期用途】
第一段内容详细说明产品的预期用途,如定性或定量检测、自测、确认等,样本类型和被测物等,具体表述形式根据产品特点做适当调整。若样本来源于特殊受试人群,如孕妇、新生儿等,应当予以注明。
第二段内容说明与预期用途相关的临床适应症及背景情况,说明相关的临床或实验室诊断方法等。
示例:本试剂供医疗机构用于体外定量测定人血清中基质金属蛋白酶3(MMP-3)的含量。做辅助诊断用。
基质金属蛋白酶3(MMP-3)是由关节滑膜细胞、纤维母细胞、巨噬细胞等产生的一种蛋白质分解酶。MMP-3因可分解蛋白多糖、各种胶原蛋白、层粘连蛋白、纤连蛋白而被认为与关节破坏有着密切的关系。在风湿性关节炎患者的滑膜组织中发现MMP-3过剩表达,患者血液中的浓度可反映其风湿性关节炎的活动性。
【检验原理】
详细说明检验原理、方法,必要时可采用图示方法描述。
【主要组成成分】
1.对于产品中包含的试剂组分:
(1)说明名称、数量及在反应体系中的比例或浓度,如果对于正确的操作很重要,应提供其生物学来源、活性及其他特性。
(2)对于多组分试剂盒,明确说明不同批号试剂盒中各组分是否可以互换。
(3)如盒中包含耗材,应列明耗材名称、数量等信息。如塑料滴管、封板膜、自封袋等。
2.对于产品中不包含,但对该试验必需的试剂组分,说明书中应列出此类试剂的名称、纯度,提供稀释或混合方法及其他相关信息。
3.对于校准品和质控品:
(1)说明主要组成成分及其生物学来源。
(2)注明校准品的定值及其溯源性。
(3)注明质控品的靶值范围。如靶值范围为批特异,可注明批特异,并附单独的靶值单。
示例:⒈试剂1(R1):###缓冲液 # mmol/L
⒉试剂2(R2):##酸缓冲液 #mmol/L #酶:#mmol/L
3.校准品/质控品:
###校准品/质控品:含量/靶值见或靶值单
注:1)不同批号的试剂不得混用。
2)该校准品赋值可溯源至####(明确产品溯源信息)。
【储存条件及有效期】
1.说明产品的储存条件如:2~8℃、-18℃以下、避免/禁止冷冻等。其他影响稳定性的条件如:光线、湿度等也必须说明。如果打开包装后产品或组分的稳定性不同于原包装产品,则打开包装后产品或组分的储存条件也必须注明。
2.有效期:说明在储存条件下的有效期。如果打开包装后产品或组分的稳定性不同于原包装产品,打开包装后产品或组分的有效期也必须注明。
3.如试剂盒各组分的稳定性不一致,则应对各组分的储存条件和有效期分别进行描述。
4. 应注明生产日期、有效期等信息标注位置。
示例:1.在2~8℃避光的储存条件下,试剂盒自生产之日起有效期为#个月。
2.试剂启用后,在2~8℃避光的条件下可以稳定#天。
3.校准品启用后,在2~8℃避光的条件下可稳定#天。
4.生产日期、失效日期见试剂盒标签。
【适用仪器】
说明可适用的仪器及型号,并提供与仪器有关的信息以便用户能够正确选择使用。
示例:【适用仪器】 迪瑞 CS600、CS1200、CS6400
【样本要求】
应在以下几方面进行说明:
1.适用的样本类型。
2. 在样本收集过程中的特别注意事项。
3. 为保证样本各组分稳定所必需的抗凝剂或保护剂等。
4.已知的干扰物。
5.能够保证样本稳定的储存、处理和运输方法。
示例:使用血清样本。样本采集后应及时测定,如不能及时测定,经本公司测试验证本产品测定用血清样本在2~8℃可稳定储存10天,在-20℃可稳定储存8个月。
【检验方法】
为保证试验的正确进行,应在以下几方面对试验的每一步进行详细说明:
1.试剂配制:各试剂组分的稀释、混合及其他必要的程序。
2.必须满足的试验条件:如pH值、温度、每一步试验所需的时间、波长、最终反应产物的稳定性等。试验过程中必须注意的事项。
3.校准程序(如果需要):校准品的准备和使用,校准曲线的绘制方法。
4.质量控制程序:质控品的使用、质量控制方法。
5.试验结果的计算或读取,包括对每个系数及对每个计算步骤的解释。如有必要,应举例说明。
示例:
试剂制备:即用型液体试剂,无需制备。
检测参数:
检测方法:胶乳增强免疫比浊法,上升反应
孵育温度:37℃
检测波长:700nm
校准模式:Spline
试剂空白:纯化水或生理盐水
下面日立7180为例,说明本品的检验方法。用户实际使用时,应向我公司索取相应机型的设置参数。
|
|
空白管(B)
|
校准管(S)
|
样品管(U)
|
|
纯化水
|
6μl
|
—
|
—
|
|
校准液
|
—
|
6μl
|
—
|
|
样品
|
—
|
—
|
6μl
|
|
试剂1
|
180μl
|
180μl
|
180μl
|
|
混匀,37°C孵育5分钟,然后加入
|
|
试剂2
|
45μl
|
45μl
|
45μl
|
|
混匀,37°C孵育40秒后,读取吸光度A1,4分20秒后,再读取吸光度A2
|
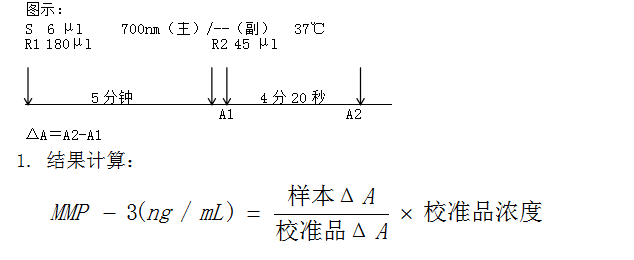
2. 校准品:推荐使用##校准品。
质控品:推荐使用##质控品或其它经验证适用的质控品。
【阳性判断值或者参考区间】
说明阳性判断值或者参考区间,并简要说明阳性判断值或者参考区间的确定方法。
示例:
男性:XXX~XXX ng/ml、女性:XXX~XXX
ng/mL
此参考区间来源于XXX个健康体检人员的试验数据,男女各XXX例,仅供参考。由于地区、性别、年龄等差异,建议各实验室根据各自的人群特点建立自己的参考值。
如产品检测多种样本类型,须分别标注参考区间或明确验证样本类型。
【检验结果的解释】
说明可能对试验结果产生影响的因素;说明在何种情况下需要进行确认试验。
【检验方法的局限性】
说明该检验方法的局限性。
【产品性能指标】
说明该产品的主要性能指标(应与产品技术要求一致)。
【注意事项】
注明必要的注意事项,如本品仅用于体外诊断等。
如该产品含有人源或动物源性物质,应给出具有潜在感染性的警告。
【标识的解释】如有图形或符号,请解释其代表的意义。
【参考文献】
注明引用的参考文献。
【基本信息】
注册人/生产企业名称
住所
联系方式
售后服务单位名称
联系方式
生产地址
生产许可证编号或者生产备案凭证编号
【医疗器械注册证编号/产品技术要求编号】:注明该产品的注册证编号或者备案凭证编号。
【说明书核准及修改日期】
注明该产品说明书的核准日期。如曾进行过说明书的变更申请,还应该同时注明说明书的修改日期。
注:以上项目如对于某些产品不适用,说明书中可以缺省。
产品说明书内容原则上应全部使用中文进行表述;如含有国际通用或行业内普遍认可的英文缩写,可用括号在中文后标明;对于确实无适当中文表述的词语,可使用相应英文或其缩写表示。
来源:上海市食品药品监督管理局认证审评中心