药械组合医疗器械如何进行注册申报之三
以医疗器械作用为主的
药械组合产品申报资料要求
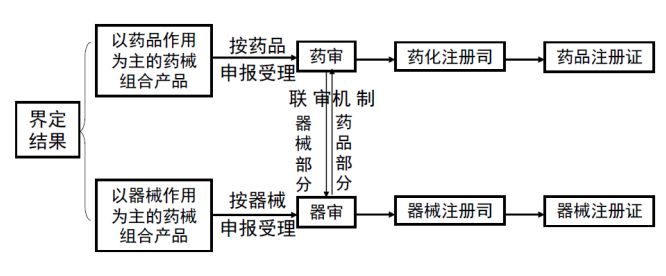
申请人根据医疗器械分类目录或产品属性审定意见,向国家药品监督管理局申报产品的注册申请,并在申请表中注明“药械组合产品”。对于以药品作用为主的药械组合产品,后续按药品进行申报受理,最终取得药品注册证;对于以医疗器械作用为主的药械组合产品(又称“含药医疗器械”),后续按医疗器械进行申报受理,最终取得医疗器械注册证。
药械组合产品中医疗器械部分除应符合《医疗器械监督管理条例》、《医疗器械注册管理办法》等法规,以及相关标准和指导原则等要求。还应提交以下资料(包括但不限于):
1.产品技术要求
产品技术要求主要包括医疗器械成品的性能指标和检验方法。其中性能指标是指可进行客观判定的成品的功能性、安全性指标以及质量控制相关的其他指标,药械组合产品中器械还应考虑其配合药品部分使用时所需具备的特殊性能要求。
2.产品技术资料
在药械组合产品的技术资料部分,建议提交以下资料(包括但不限于):
①
药械组合产品中器械部分的描述,建议明确以下信息:包括器械名称、性能结构组成、示意图、预期功能、与药物的组合方式等。
②
与药物组合后,对器械部分的预期用途、安全有效性、稳定性等的影响或改变;该类产品含药及不含药的疗效对比报告。
③
生产工艺:生产者应根据药物及器械的理化特性和药物与器械的相互作用,制定合理的生产工艺、有效的质量控制措施及控制指标。
④ 原材料及终产品的质控要求。
⑤
其他相关资料。
3.药品部分和器械部分的相互作用
建议申请人针对药械组合产品中药品部分与器械部分之间的潜在相互作用,考虑以下问题并提交相关技术资料(包括但不限于):
①
药品部分与器械部分组合方式的合理性。
②
药品部分与器械部分形成药械组合产品时,与其单独批准时的适应证、适用人群等相比是否发生改变。对于药品部分,还应当考虑其配方、灭菌、病毒灭活、输送方法、给药途径、释放量和释放型式、药效、活性、体内过程及代谢产物等是否发生变化及带来的影响;对于器械部分,还应当考虑其配合药品部分使用时所需具备的特殊性能要求。
③ 药品含量确定的依据,与单独使用时相比其给药剂量、安全阈值、局部和系统毒性等是否发生变化;器械对药品的粘附/吸收是否会影响实际给药剂量。
④
当用器械作为载体负载、储存、输送药品时,或药品作为器械涂层或加入到器械的原材料中时,药品部分的稳定性、活性等是否发生变化;终产品的贮存、运输等方面是否有特殊要求。
⑤
器械原材料的可沥滤物/浸提物、器械的无活性降解物或生产过程残留物是否影响药品部分,最终是否影响终产品的安全性;在药械组合产品使用过程中,器械的作用(特别是与有能量激发的器械一起使用时)是否会改变药品部分的性能特征。
⑥
药品部分对器械部分可能产生的影响。
4.证明产品安全、有效所需的其他资料。
(参考文献《我国药械组合产品的申报流程、基本情况介绍及器械部分申报资料要求》,田佳鑫等,国家食品药品监督管理总局医疗器械技术审评中心)
案例分析
我们以抗菌导尿管为例,简单分析一下含抗菌剂医疗器械的申报资料中临床前部分常见问题。
1.产品属性和分类:
根据国家药品监督管理局2017年09月发布的《关于发布医疗器械分类目录的公告》(2017年第104号),抗菌导尿管应为按照医疗管理的药械组合产品。
|
产品名称
|
产品描述
|
预期用途
|
分类编码
|
管理类别
|
|
含药导尿管
|
一般采用高分子材料制成。部分头端固定有球囊。可将头端插入膀胱,并向体外导尿。含药物成分。无菌提供,一次性使用。
|
用于将病人膀胱中的尿液经尿道向体外导出并导入到集尿容器中。
|
14-05-03
|
III(药械组合)
|
2.申报资料临床前部分关键问题阐明:
抗菌导尿管中的导尿管除应符合《医疗器械监督管理条例》、《医疗器械注册管理办法》等法规,以及相关标准和指导原则等要求。还应提交以下资料(包括但不限于):
√
抗菌剂的配方比例及用量、稳定性、给药途径、释放量和释放型式、药效、活性、体内过程及代谢产物、安全阈值等与其单独使用时是否发生变化及带来的影响;
√
产品中添加抗菌剂的方法:阐明将抗菌剂添加到医疗器械中的生产过程,如抗菌剂的浓度、涂层厚度、抗菌剂如何结合到器械等。
√
添加抗菌剂后,产品的生产工艺(包括灭菌、病毒灭活等)、贮存、运输等是否发生变化及其对产品的影响;
√
抗菌剂含量确定的依据,是否能发挥抗菌作用,随器械的使用是否突破机体自身的血药屏障,是否产生局部和系统毒性,连续使用的累积效应、使用时限,是否导致耐药等;
√
考虑器械对抗菌剂的影响,如器械对抗菌剂的粘附/吸收是否会影响其实际剂量,器械原材料的可沥滤物/浸提物、器械的降解物或生产过程残留物是否影响抗菌剂,是否影响终产品的安全性;
√ 产品中添加抗菌剂的量:应明确在器械中添加抗菌剂的剂量,确定产品中抗菌剂的起始浓度
√ 抗菌剂的最低有效浓度::最低有效浓度建议表示为每单位面积的浓度和单个器械中的总浓度,应在与器械的临床使用一致的条件下确定抗菌剂的最低有效浓度。
√ 阐明抗菌剂的作用机制,并提交抗菌剂如何发挥作用的研究资料;提交所添加抗菌剂的抗菌谱研究资料。
原创: CIRS-MD CIRS医疗器械监管动态
【本文内容为转载,我公司不对本文所包含内容的准确性、可靠性或者完整性提供任何明示或暗示的保证,不对本文观点负责。如转载内容涉及版权等问题,请立即与我们联系,我们将迅速采取适当措施,以保障双方权益,谢谢。】