企业实施医疗器械唯一标识(UDI)常见问题全解答
医疗器械唯一标志(Unique Device Identification,通称UDI)是医疗器械的身份证件,医疗器械唯一标识系统由医疗器械唯一标志、数据信息媒介和数据库查询构成。
由于医疗器械产品风险和监管追溯要求的不同,其器械的UDI也随之不同。
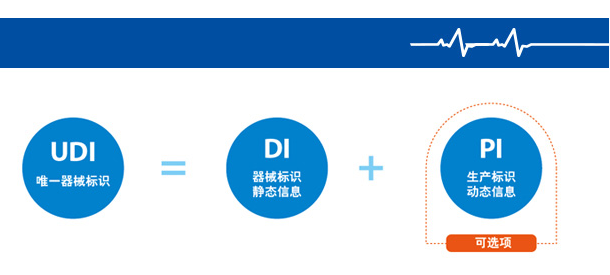
器械识别码(DI)属于静态信息,它是医疗器械产品在供应链中的身份标识,可作为进入数据库查询该产品追溯基本信息的“关键字”;而生产识别码(PI)属于动态信息,它包括医疗器械产品的序列号、批号、生产日期和有效期等,是医疗器械产品的动态附加信息。
2020年7月23日,国务院办公厅发布《深化医药卫生体制改革2020年下半年重点工作任务》,明确要求“重点品种实施医疗器械唯一标识”,为了帮助企业推进相关工作,UTC整理并解答了实施过程中常见问题,供大家参考。
Q&A
1.什么是UDI?
医疗器械唯一标识(简称 UDI)是医疗器械产品的电子身份证,与唯一标识数据载体、唯一标识数据库共同组成医疗器械唯一标识系统。UDI由产品标识静态信息(DI)和生产标识动态信息(PI)组成。
DI属于产品静态信息,它作为医疗器械在相关数据库中的”索引”,是医疗器械在整个供应链上的”身份证”。
PI属于动态标识信息,它可以包括医疗器械产品的生产日期、有效期、失效日期、灭菌批号等附加的信息。
PI与静态信息(DI)组成后可指向特定的医疗器械产品,根据UDI的组成可完成对医疗器械的追溯。
2.国家为什么要实行UDI
医疗器械在流通使用环节普遍存在无码或者一物多码现象,标识不统一、跨环节难识别等问题,严重影响医疗器械在生产、流通、使用等各环节的监督与溯源,导致市场管理难、问题追责难、防伪打假难。作为关系国计民生的重要领域,医疗器械统一标识势在必行。
2019年10月15日国家药监局发布《关于做好第一批实施医疗器械唯一标识工作有关事项的通告》,开始推进医疗器械唯一标识工作。
2020年7月23日,国务院办公厅发布《深化医药卫生体制改革2020年下半年重点工作任务》,明确要求“重点品种实施医疗器械唯一标识”。
7月24日,国家药监局召开医疗器械唯一标识系统试点工作推进会,“将检查医疗器械对医疗器械唯一标识的落实情况”,“做好唯一标识试点企业的督促检查工作”。
截至目前,医疗器械唯一标识(UDI)第一批试点数据报送接近尾声,全国范围内UDI报送即将全面推行。
3.企业不属于国家药监局第一批试点企业/企业主要产品不在试点产品名录上,是否需要实施UDI?
国家推行UDI势在必行。根据国药监局规划,将在近年内覆盖全国所有医疗器械。本次第一批试点工作只是开始,未来将进一步推动相关工作有序、迅速开展,不仅仅只针对单一类别器械。
在UDI的领域,国内不少龙头企业已经快人一步完成了UDI体系的建设,占据先发优势。
对于其他医疗器械企业而言,无论是几类产品、是否为试点企业,都应提前做好战略准备,充分规划唯一标识在企业管理、产品追溯等领域的应用,争取在未来竞争中弯道超车。
4.企业实施UDI工作有没有截止时间?具体是什么时候?
根据国家药品监督管理局2019年10月15日发布的《关于做好第一批实施医疗器械唯一标识工作有关事项的通告》要求,“2020年10月1日起,生产列入首批实施目录的医疗器械,应当具有医疗器械唯一标识”。
对于其他非试点企业,目前暂无具体要求时间,但建议提前做好战略准备,为未来UDI工作全面实施奠定基础。
5.DI部分如何上报药监局?
① 对于编码团队完备的企业,可以在药监局自主注册审核并提交DI数据报送。药监局数据库面向企业开放注册,企业需提交相关信息与表格并接受人工审核。
② 对于目前没有UDI团队的企业,建议通过UDI申报赋码平台,将DI数据批量、一键上传至药监局数据库审核申报。
此外,平台还能兼容其他编码规则,可将已有的编码上传药监局数据库。使用UDI申报赋码平台,可为企业节约对接成本、降低出错风险,并提供数据储存与管理的服务。
6.PI部分能否自行编码?
根据现行要求,在UDI实施过程中,PI部分可以由企业自行编码。但企业自行编码的前提是对整体编码规则非常熟悉,能独立完成相关工作。
同时还应考虑编码的通行性,若编码结构以及识读通行性不够,上市后可能会存在某些特殊字段无法识读的情况。后续如果因编码问题发生产品召回等情况,将给企业极大的负面影响。
另外,自行编辑PI编码,随着UDI编码量增大,还存在数据存储、查询、流通、应用等问题,需要企业花费较大的人力和物力来完成。
7.企业能否使用Excel表来记录编码数据
按照目前规则,企业自行保管编码数据。因此理论上可以使用Excel表来记录编码数据。但通过Excel等文件记录很容易编写错误。文件传输过程中,需经手多个部门,易造成数据错误、错漏、版本不统一等情况,为后续检查带来麻烦。且该方式需要花费大量人工、物力成本,需要安排专员学习、使用、保管相关编码规则和数据。
采用UDI申报赋码平台可以避免上述问题,平台一键自动生成的编码,通过API接口无缝对接企业生产ERP系统,实现生产数据流通。
8.UDI申报赋码平台是什么?
UDI服务平台
慧铭科技针对医疗行业,专注研究与分析医疗行业供应链管理难点重点,为医疗器械供应链各环节提供精细化管理解决方案,全面构建了医疗行业的信息化技术和数字化贸易基础设施技术。凭借长期对医药行业及国家医改政策的把握,全新构建了UDI服务平台,基于标准化产品,实现企业的标识防伪、产品溯源、渠道管控、智慧营销、大数据应用和智慧包装等业务,通过标识、软件、自动化实现各环节的信息追溯、信息数据关联与共享,助企业数字化转型。
9. UDI服务平台有哪些优势?
权威发码平台,国家药监局指定的发码平台;
一键编码,无需手工编写PI部分;
一键上传药监局数据库,符合规范要求;
兼容性好,可无缝衔接现有编码机制;
实施成本低,为企业节约大量人力物力;
数据保密性高,采用我国自主知识产权编码,保障信息安全;
10.企业已有其他编码,转换成UDI编码是否很麻烦?
如要更改发码体系,只需注册UDI申报赋码平台,获取UDI编码,平台支持直接上报药监局、对接企业内部生产管理系统,当天即可实现转换,企业的生产不会受到任何影响。
赋码方面,码制转换对赋码设备没有任何影响,无需更换赋码设备。
识读方面,目前市面上的识读设备都广泛支持QR码的扫码识读。
来源:医械小灵通
【本文内容为转载,我公司不对本文所包含内容的准确性、可靠性或者完整性提供任何明示或暗示的保证,不对本文观点负责。如转载内容涉及版权等问题,请立即与我们联系,我们将迅速采取适当措施,以保障双方权益,谢谢。】