医用红外人体测温成像设备技术审评要点(试行)
本审评要点是对医用红外人体测温成像设备的一般要求,申 请人应当依据产品的具体特性确定其中内容是否适用,若不适用, 需具体阐述理由及相应的科学依据,并依据产品的具体特性对注 册申报资料的内容进行充实和细化。
本审评要点是供申请人和审查人员使用的指导文件,不涉及 注册审批等行政事项,亦不作为法规强制执行,如有能够满足法 规要求的其他方法,也可以采用,但应当提供详细的研究资料和 验证资料。应当在遵循相关法规的前提下使用本审评要点。
本审评要点是在现行法规、标准体系及当前认知水平下制定 的,随着法规、标准体系的不断完善和科学技术的不断发展,相 关内容也将适时进行调整。
—'适用范围
本审评要点适用于医用红外人体测温成像设备的注册申报。 医用红外人体测温成像设备是指通过红外测温技术对人体表面温 度进行非接触快速测量,当被测温度达到或超过预设警示温度值 时进行警示的仪器。
根据《医疗器械分类目录》(原国家食品药品监督管理总局 公告2017年第104号)以及《浙江省药品监督管理局办公室关于 开展《浙江省医用红外测温设备技术审评要点订工作的通知》 (浙药监办发函〔2020〕112号)规定,申报产品的管理类别为第 二类,产品分类编码为07-03-04。
二、技术审查要点
(一)产品名称的要求
产品的名称应当符合《医疗器械通用名称命名规则》(原国 家食品药品监督管理总局令第19号令)、《医疗器械分类目录》 (原国家食品药品监督管理总局公告2017年第104号)以及相关 法规、规范性文件的要求。产品名称应当以体现产品的工作原理、 技术结构特征、功能属性为基本准则,例如:医用红外人体测温 成像仪。
(二)产品的结构和组成
产品通常由光学镜头、红外探测器、信号处理单元、图像处 理单元、系统处理软件、视频线、黑体(若适用)组成。选配部 件:如支架等。选配部件应当在产品结构组成中明确。
若是内部电源供电,如锂电池,则电池应当作为产品结构组 成的一部分。对于通过电源适配器外接电源的情形,如果电源适 配器作为产品结构组成的一部分,则要在安规和电磁兼容检测时 与主体部分一同检测;如果不作为申报产品的结构组成,则要在 说明书中明确对电源适配器的要求,由使用单位自行配置。
一些可能配套使用的产品:移动工作台、TF卡等,可以不作 为申报产品注册单元内的结构部件,而作为产品配套使用的部件, 但是需要明确配套使用的接口要求等。
常见的结构形式有固定式和手持式。固定式是指安装在支架 或者墙壁上,以固定的状态进行工作,可以实现人体温度的实时 测量。手持式是指由使用人员手持产品对被测对象进行温度测量。常见的结构形态如下:


(三)产品工作原理
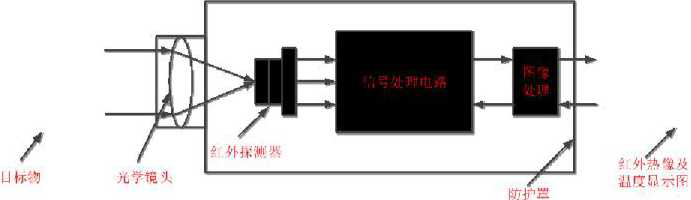
物体辐射的红外能量与温度成正比关系。对于固定式医用红外人体测温成像设备,红外热成像测温的过程是将被测目标的红 外辐射通过镜头聚焦到探测器的靶面,产生与目标温度成正比的 对应电荷,经过探测器的扫描电路产生反映目标表面热状态的热 电信号。然后,通过信号处理系统对热电信号进行模数转换、信号放大、噪声处理等,最终通过不同灰度显示出来。再通过黑体 进行测温标定,建立灰度与温度的对应关系,实现测温功能。测 量出人体表面温度后,再通过转换关系(算法补偿),转换为人体 体温,从而实现人体温度实时测量。当人体温度超出设定阈值时, 设备会发出声光警示,以便工作人员对高温目标进行相应的二次 确认或干预动作。
对于手持式医用红外人体测温成像设备,工作原理与上述固定式的会有细微差异,如可能不需要黑体进行测温标定,注册申 请人如实表述即可。
(六)产品参考适用的相关标准
表1参考标准列表
|
标准编号
|
标准名称
|
|
GB/T191-2008
|
包装储运图示标志
|
|
GB 9706.1-2007
|
医用电气设备第1部分:安全通用要求
|
|
GB 9706.15-2008
|
医用电气设备第1・1部分:安全通用要求并列标准:医用电气系统安 全要求
|
|
YY 0505-2012
|
医用电气设备第1-2部分:安全通用要求并列标准:电磁兼容要求和试验
|
|
GB/T 14710-2009
|
医用电器设备环境要求及试验方法
|
|
GB/T 16886.1-2011
|
医疗器械生物学评价第1部分:风险管理过程中的评价与试验
|
|
GB/T 16886.5-2017
|
医疗器械生物学评价第5部分:体外细胞毒性试验
|
|
GB/T 16886.10-2017
|
医疗器械生物学评价第10部分:刺激与迟发型超敏反应试验
|
|
GB/T 19146-2010
|
红外人体表明温度快速筛检仪
|
|
GB/T 19665-2005
|
电子红外成像人体表面测温仪通用规范
|
|
GB/T 21417.1-2008
|
医用红外体温计第一部分:耳腔式
|
|
YY/T 0466.1-2016
|
医疗器械用于医疗器械标签、标记和提供信息的符号第1部分:通用 要求
|
|
YY/T 0316-2016
|
医疗器械风险管理对医疗器械的应用
|
(七)产品研究资料
1. 生物相容性评价研究
按照GB 16886. 1-2011开展生物相容性评价。应当对成品中 与患者和使用者直接或间接接触的材料的生物相容性进行评价。
生物相容性评价研究资料应当包括:生物相容性评价的依据 和方法;产品所用材料的描述及与人体接触的性质;实施或豁免 生物学试验的理由和论证;对于现有数据或试验结果的评价。
2. 产品有效期和包装研究
有效期的确定:若适用,应当提供产品有效期的验证报告, 参考《有源医疗器械使用期限注册技术审查指导原则》。
包装及包装完整性:在宣称的有效期内以及运输储存条件下, 保持包装完整性的依据。可以基于环境试验的结果进行论证。
3. 软件研究
产品结构组成中包含作为医疗器械组成部分的软件,应当按 照《医疗器械软件注册技术审查指导原则》的要求提供一份单独 的医疗器械软件描述文档,内容包括基本信息、实现过程和核心 算法三部分内容。同时,应当出具关于软件版本命名规则的声明, 并明确软件完整版本的全部字段及字段含义,确定软件的完整版 本和发行所用的标识版本。
产品的核心算法包括人脸检测、温度补偿等。
产品若符合《医疗器械网络安全指导原则》中的适用情形, 应当提交网络安全描述文档,并在产品技术要求中规定用户访问 控制、数据传输协议等性能指标。数据传输协议应当考量摄像头
与系统处理软件的接口,系统处理软件与外界连接的接口,摄像 头自身的存储接口等。
(八)产品技术要求包括的主要性能指标
1. 产品型号/规格及其划分说明
1.1型号规格。
1.2产品基本信息:尺寸(长度、宽度、高度)。
1.3软件信息:软件版本命名规则、发布版本、软件运行环境。
1.4 正常工作环境条件
工作场所:室内(不用于室外)。
环境温度:10℃ ~32℃
相对湿度:小于等于85%。
大气压力:70kPa~106kPa。
电源:AC220(1±10%)V; 50( 1±2%)Hz或/和内部直流电源,
由注册申请人自行规定。
2. 性能指标
2.1基本要求
外表面及其各种配件的壳体应当整洁,色泽均匀,不应出现 明显的划痕、凹陷、变形、脱漆、污迹及裂纹等缺陷。
2.2显示与界面
具有温度显示及状态指示功能,应当使用中文界面。 无需调节镜头可以保持测温距离内的物体图像清晰。
显示分辨力为0.1℃ 或者更优。
在下列项目超出制造商规定的限度时提示操作者:显示范围、 电源电压(内部电源)、环境温度。
2.3双通道画面(可选项)
具有可见光和热成像两个通道,可以实时显示可见光和热成 像画面。
2.4测温模式
产品具有体温模式,并指示所设定的显示模式。
产品具有校准模式,该模式可以直接设定或通过体温模式的 换算技术来获得。
2.5区域测温
对已形成的热像图中应当具有下列测温功能:
对热像图中的任意点温度测量和显示功能。
热像图中最高温区的指示和跟踪功能。
具有温场屏蔽功能,即对热图像中的某些区域不测温的功能 (可选项)。
对热像图中的任一矩形(及方形)区域测量平均温度、最高 温度和最低温度(可选项)。
对热像图中的任一不规则区域测量平均温度、最高温度和最 低温度(可选项)。
热图像的冻结功能(可选项)。
2.6温度显示范围
温度显示范围不窄于28.0 ℃-42 ℃。
2.7视场
视场指通过医用红外人体测温成像设备的入瞳能形成有效热 像图的最大锥形或扇形的光学角,单位为度。注册申请人应当在 垂直和水平两个方向规定视场的最小角度。
2.8工作距离
注册申请人应当规定产品的最小和最大工作距离。一般应当 在0.3m~5m范围内。
2.9准确度
在规定的工作环境条件下,当黑体温度为33℃~37℃时,实验 室误差不大于0.3℃。
在规定的工作环境条件下,当黑体温度低于33℃或高于37℃ 时,实验室误差不大于0.4℃。
2.10警示相应时间
警示响应时间不大于1s。
2.11测温一致性
测温一致性应当不超过±0.2℃。
2.12温度分辨率(NETD)
NETD ≤ 0.1℃
2.13温度测量重复性
温度测量重复性 ∂ ≤0.2C。
2.14温度警示功能
显示温度值达到或者超过预设温度值时,发出灯光或声音的 警示。
应当具备屏幕指示功能。
温度警示阈值可以由操作者设置,音量以及灯光可以调节(可 选项)。
警示功能可以关闭(可选项)。
产品发出警示时,自动存储图片和录像功能(可选项)。
2.15数据接口
制造商应当明确数据传输所采用的协议,包括通用协议和自定义协议,如HTTP等。
2.16用户访问控制
使用账号密码登陆形式保护设备内容,至少包含管理员和普 通用户组,管理员可以管理用户,设置不同用户的权限。
制造商应当明确相应的权限,如用户管理、预览、回放、系 统管理、系统信息、手动控制、文件备份、存储管理、事件管理 等(可选项)。
2.17支架(可选项)
摄像头应当能在支架上固定,支架安装平面距离地面高度应 当适中,可以作升降、仰俯、左右摆动,任意工作位置均能可靠 锁止。
2.18环境试验要求
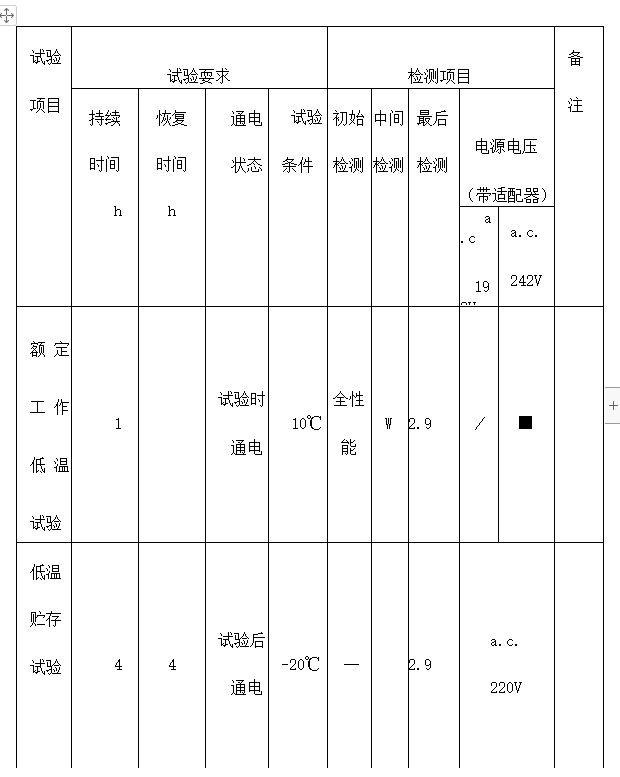
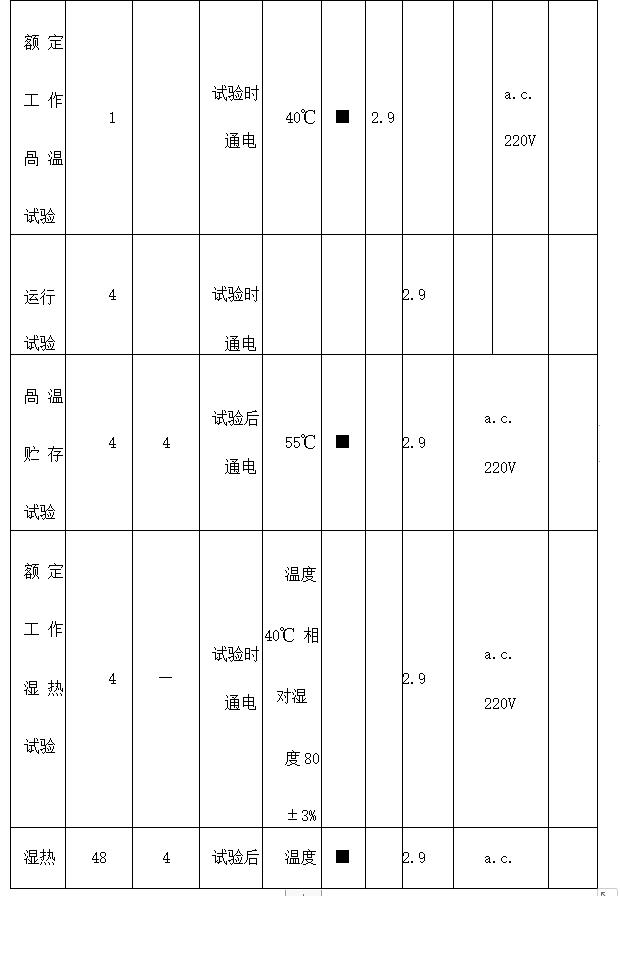
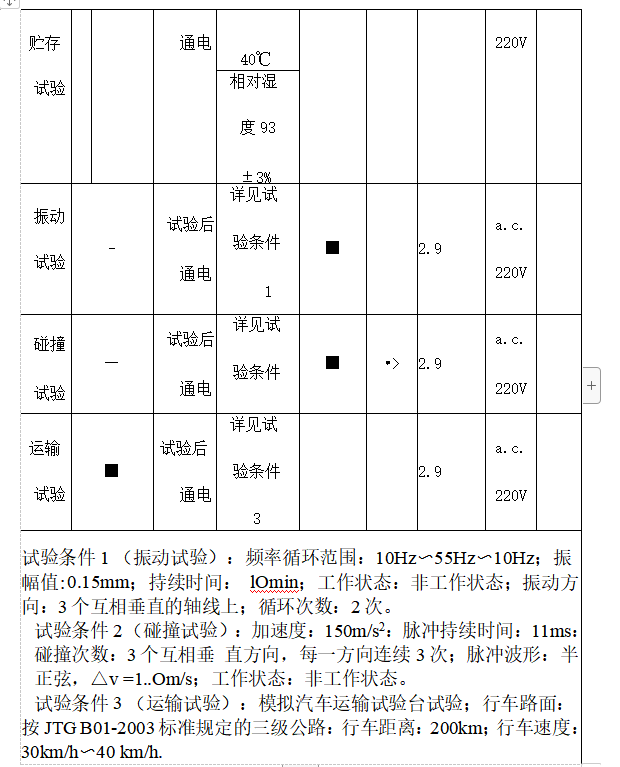
气候环境试验可以参照GB/T 14710-2009中气候环境试验II组的规定执行,也可以参照表2中气候环境试验条件执行。机械 环境试验按照GB 19146-2010中表1的规定执行。运输试验及电源电压适应能力试验分别按GB/T 14710-2009中第4、5章的规定。
表2环境试验要求及检验项日
2.19电气安全
电气安全符合 GB 9706.1-2007. GB 9706.15-2008 (若适用) 的要求。在技术要求附录中应当列明产品安全特征。
2.20电磁兼容性
电磁兼容性符合YY 05092012要求。
3.检验方法要求
3.1实验室条件
实验室的温度为(23±3) ℃,相对湿度为(55±15)%RH,实 验室的照明应当使医用红外人体测温成像设备测量结果和图像质 量不受到明显的影响,实验室的空气达到清洁要求。
3.2实验设备的要求
3.2.1试验所使用的仪器设备应当经有资质的校准实验室检 定或校准。
3.2.2 黑体应当符合以下要求:
a) 温度范围:覆盖本标准实验要求所需的全部温度范围,且连续可调;
b)有效发射率:>0.997;
C)温度的不确定度:不超过0.13℃;
d)温度稳定度:0.05℃/10min;
e)黑体的有效靶面应当能满足被测红外人体测温仪的试验要 求。
(九)同一注册单元中典型产品的确定原则和实例
同一注册单元应当按产品风险与技术指标的覆盖性来选择典型产品。典型产品应当是同一注册单元内能够代表本单元内其他 产品安全性和有效性的产品,应当考虑功能最齐全、结构最复杂 的型号。
对于电磁兼容检测的典型性覆盖问题,应当按照《原国家食 品药品监督管理局办公室关于丫丫 0505-2012医疗器械行业标准实施有关工作要求的通知》(食药监办械〔2012〕151号)要求,向 医疗器械检测机构送检全部型号,由后者出具相应电磁兼容报告 或电磁兼容的典型性说明,以供技术审评部门参考。
(十)产品的临床评价要求
对于注册人首次申报的产品,按照《医疗器械临床评价技术 指导原则》(原国家食品药品监督管理总局通告2015年第14号附 件)要求提交临床评价资料。产品可以按照《免于进行临床试验 目录》中的额温计(分类编码:07-03-04)进行评价。同时,应当 提供临床准确性的临床验证资料。
临床准确性的验证方案可以参照GB 21417.1-2008附录A进 行,包括样本量要求和人群年龄分布等。需要考量的因素:工作 距离、适用场所。对照产品选择已经上市的体温测量器械。
对于已经获得该类产品医疗器械注册证的情况,企业在后续 同类产品注册时,可以按照“同品种比对路径”进行临床评价,分 析两者在核心部件(传感器探头)、核心算法等方面的差异性,并 通过实验室数据证明差异性不对产品的准确性产生影响。若无法 证明两者的实质性等同,则应当开展临床验证。
(十一)产品说明书和标签要求
产品说明书、标签和包装标识的编写应当符合《医疗器械说明 书和标签管理规定》(原国家食品药品监督管理总局令第6号)、YY/T 0466.1-2016《医疗器械用于医疗器械标签、标记和提供信息的符号第1部分:通用要求》、GB 9706.1-2007《医用电气设备第 1部分:安全通用要求》及YY 0505-2012《医用电气设备第1-2部 分:安全通用要求并列标准:电磁兼容要求和试验》等相关标准的规 定。应当重点关注产品的适用场所和使用方法。