关于发布医用X射线诊断设备(第三类)同品种临床评价注册审查指导原则等的多条通告
国家药监局器审中心关于发布正电子发射/X射线计算机断层成像系统同品种临床评价注册审查指导原则的通告
为进一步规范正电子发射/X射线计算机断层成像系统的管理,国家药监局器审中心组织制定了《正电子发射/X射线计算机断层成像系统同品种临床评价注册审查指导原则》,现予发布。
特此通告。
附件:正电子发射/X射线计算机断层成像系统同品种临床评价注册审查指导原则
国家药品监督管理局
医疗器械技术审评中心
2023年8月3日
附件
正电子发射/X射线计算机断层成像系统
同品种临床评价注册审查指导原则
本指导原则旨在指导注册申请人对正电子发射/X射线计算机断层成像系统(下文简称PET/CT)开展同品种临床评价,同时也为技术审评部门审评PET/CT同品种临床评价资料提供参考。本指导原则是对2020年发布《正电子发射/X射线计算机断层成像系统注册技术审查指导原则》临床评价相关要求的修订。
本指导原则是对PET/CT同品种临床评价的一般要求,申请人需依据产品的具体特性确定其中内容是否适用。若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
本指导原则是供注册申请人和技术审评人员使用的指导性文件,但不包括审评审批所涉及的行政事项,亦不作为法规强制执行,需在遵循相关法规的前提下使用本指导原则。如果有能够满足相关法规要求的其他方法,也可以采用,但是需要提供详细的研究资料和验证资料。
本指导原则是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本指导原则的相关内容也将进行适时的调整。
一、适用范围
本指导原则适用于PET/CT的同品种临床评价工作。按现行《医疗器械分类目录》[1],PET/CT分类编码为06-17-02,管理类别为III类。
拟评价设备的CT部分可以参考《X射线计算机体层摄影设备同品种临床评价技术审查指导原则》[2]。PET/MR的PET部分的同品种临床评价亦可参考本指导原则中的PET相关章节。
注册申请人需全面评价PET/CT的硬件、软件的功能。考虑PET/CT功能的多样性,本指导原则仅就PET/CT的医学影像质量,有针对性地提出和规范了临床评价要求。
若拟申报产品与境内已上市产品相比,某关键器件(含软件)具有全新的技术特性,或拟申报产品具有全新的临床适用范围,若不能通过非临床研究数据、人体影像样本数据等证据资料证明申报产品的安全性和有效性,注册申请人需要考虑通过临床试验来获得临床数据。
二、基本原则
注册申请人需遵循科学、客观的原则,根据申报产品实际情况确定临床评价路径,依据《医疗器械临床评价等同性论证技术指导原则》[3],提供相应的临床评价资料。
注册申请人通过同品种的方式开展临床评价,需针对拟申报产品和同品种产品之间的差异性,提供有效的科学证据,以评价差异性是否对申报产品的安全性和有效性产生不利影响。一般而言,差异性对图像质量的影响需提供实验室数据(如模体试验)等非临床研究数据,必要时需提供人体影像样本等数据予以确认。模体试验要求详见本指导原则第五章节,人体影像样本的确认要求详见本指导原则第六章节。
三、同品种临床评价
注册申请人可选择一种或多种同品种产品,并根据产品特征选择合适的对比项目,基于详实的研究结果,分析拟申报产品和同品种产品是否存在差异。对比项目包括但不限于附件1所述。
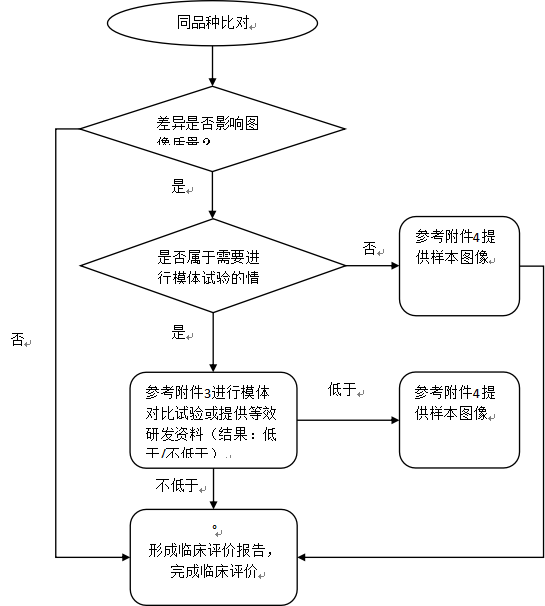
针对拟申报产品与同品种产品的差异,注册申请人需分析差异性是否对产品的安全性和有效性产生不利影响,将拟申报产品自身的数据作为支持性资料。注册申请人还需进一步评价差异是否影响图像质量,以及上述影响的程度和范围,必要时提供模体试验结果、人体影像样本数据进行确认。
若关键部件(如探测器晶体材料类型更换、新增飞行时间性能参数等)差异影响图像质量,注册申请人需开展相应模体试验,根据模体图像分析拟申报产品和同品种产品在成像性能方面的差异性,模体试验研究亦可提供同品种等效研究的文献。拟申报产品模体图像的性能指标不低于同品种产品时,则拟申报产品可视为符合预期的临床应用要求;原则上,拟申报产品性能指标不应显著低于同品种产品;拟申报产品模体图像的性能指标低于(全部或部分性能指标低于)同品种产品,注册申请人需要提供人体影像样本予以确认,或提供等效研究的临床文献和资料。
PET/CT系统的同品种评价路径详见附件2。
四、模体试验基本原则
模体试验的要求和方法可参考YY/T 0829《正电子发射及X射线计算机断层成像系统性能和试验方法》中4.1章节(即GB/T 18988.1)或附录A(即NEMA NU2)的要求执行[4,5],并遵循以下原则:
(一)基本原则
注册申请人根据对比差异实施模体试验,模体试验方案需充分验证拟申报产品和同品种产品的差异性。
(二)试验目的
模体试验的目的是获得拟申报产品与同品种产品图像质量/性能指标的比较;拟申报产品与同品种产品的模体试验指标需按照标准方法[4,5]进行测试。
(三)试验条件
拟申报产品和同品种产品的试验条件应一致;需在相同的扫描条件下进行试验,选取的扫描条件需具有可比性和典型性。
(四)试验报告模板
模体试验报告模板见附件3。
五、人体影像样本的确认原则
(一)评价对象
注册申请人需基于人体的图像进行评价,需说明获取的人体图像的具体信息,保证提供的图像的真实性。
(二)评价人员
需有经验的专业从事3年以上核医学影像诊断的医生阅片。
(三)评价部位及其样本例数
人体影像需覆盖申报的部位,图像样本不少于30[6]幅。
(四)评价标准
申请人应至少采用双人独立评价的方式,若同一患者的两份评价结果不一致时,以较低评价为准;也可采用高水平第三人仲裁。若选用仲裁判定方式,需明确规定仲裁判定标准。
推荐使用李克特(Likert)1-5分制量表评估图像质量。
若评价单独的影像,推荐使用表1-1格式进行评价,具体如下:
表1-1 影像评分表
|
评分
|
评价内容
|
|
5分
|
图像质量优秀,可用于诊断,非常满意
|
|
4分
|
图像质量良好,可用于诊断,满意
|
|
3分
|
图像质量有瑕疵,不影响诊断,一般
|
|
2分
|
图像质量欠佳,影响诊断,欠满意
|
|
1分
|
图像质量差,不能诊断,不满意
|
若评价境内已上市产品相比使用的新技术前后的影像质量差异,参考使用表1-2格式进行评价。
表1-2 采用新技术的影像评分表
|
评分
|
具体内容
(均为采用新技术图像对比未采用图像)
|
|
5分
|
使用某种技术后图像质量明显优于使用某种技术前图像质量,可用于诊断,
|
|
4分
|
使用某种技术后图像质量好于使用某种技术前图像,可用于诊断
|
|
3分
|
使用某种技术后图像质量基本等同于使用某种技术前图像质量,可用于诊断
|
|
2分
|
使用某种技术后图像质量低于使用某种技术前,图像质量欠佳,影响诊断,欠满意
|
|
1分
|
使用某种技术后图像质量低于使用某种技术前,图像质量差,不能诊断,不满意
|
(五)人体影像样本验证报告的要求
需覆盖典型配置及临床协议(至少包括头部、体部常规临床协议),相关模板和要求详见附件4。
(六)伦理要求
人体影像确认研究(含获取人体图像的过程)需符合研究所在地法规的要求。对于造影检查,须严格执行相关要求和操作规程,做好处理抢救过敏及毒性反应的准备工作。
六、其它
若申报产品包含的某一软件功能模块曾跟随其它PET/CT系统或作为独立软件在中国境内已上市,则申请人需评价该软件功能模块是否对申报产品的兼容性产生了影响。若评估无不利影响,申请人可提供证明该软件功能模块的境内上市证明性资料,包括注册证、产品技术要求、说明书相关章节等,并说明两者的实质等同性。
七、参考文献
[1]原国家食品药品监督管理总局.医疗器械分类目录:总局关于发布医疗器械分类目录的公告2017年第104号[Z].
[2]国家药品监督管理局.X射线计算机体层摄影设备同品种临床评价技术审查指导原则:国家药监局关于发布影像型超声诊断设备同品种临床评价技术审查指导原则等2项注册技术审查指导原则的通告2021年第2号[Z].
[3]国家药品监督管理局.医疗器械临床评价等同性论证技术指导原则(2021):国家药监局关于发布医疗器械临床评价技术指导原则等5项技术指导原则的通告2021年第73号[Z].
[4]YY/T 0829,正电子发射及X射线计算机断层成像系统性能和试验方法[S].
[5]NEMA NU2-2007,Performance Measurements of Positron Emission Tomographs[S].
[6]Guidance for Industry and Food and Drug Administration Staff.[EB/OL].(1998-12-03)[2022-10-17].https://www.fda.gov/regulatory-information/search-fda-guidance-documents/guidance-submission-premarket-notifications-emission-computed-tomography-devices-and-accessories.
[7]国家药品监督管理局.正电子发射X射线计算机断层成像系统注册技术审查指导原则:国家药监局关于发布用于放射治疗的X射线图像引导系统和正电子发射/X射线计算机断层成像系统2项注册技术审查指导原则的通告2020年第13号[Z].
[8]国家药品监督管理局.正电子发射/X射线计算机断层成像系统(数字化技术专用)注册审查指导原则:关于发布生物安全柜注册审查指导原则等2项技术指导原则的通告2021年第108号[Z].
附件1
申报产品与对比器械的对比项目表格
|
序号
|
对比项目
|
申报
产品
|
对比
器械
|
差异性
|
支持性资料概述
|
|
1.基本原理
|
工作原理
|
|
|
|
|
|
2.结构组成
|
2.1
|
产品组成
|
|
|
|
|
|
2.2
|
核心部件
|
|
|
|
|
|
3.性能要求
|
3.1
|
性能参数
|
|
|
|
|
|
3.2
|
功能参数
|
|
|
|
|
|
4
|
软件核心功能
|
|
|
|
|
|
5.适用范围
|
5.1
|
适用人群
|
|
|
|
|
|
5.2
|
适用部位
|
|
|
|
|
|
6
|
禁忌证
|
|
|
|
|
|
7
|
防范措施和警告
|
|
|
|
|
附件2
附件3
模体试验报告模板
一、试验方法概述
应概述模体试验的设计目的。
二、参考标准
参照YY/T 0829《正电子发射及X射线计算机断层成像系统性能和试验方法》。
三、试验指标
根据评估得出的可能存在影响的图像性能指标,例如:空间分辨率、灵敏度、复原系数、临床情况下的分辨能力测试、PET/CT融合图像指标等。
四、试验用仪器和体模
应提供测试仪器和模体的列表,说明型号、编号、校准日期(如适用),描述模体的技术参数。
五、试验条件
(一)工作条件
包括电源条件、温湿度和大气压等环境条件。
(二)扫描条件
参照YY/T 0829标准和产品技术要求的典型扫描条件进行模体试验。
在此列明拟申报产品与同品种产品在各扫描模式下的典型扫描条件。
典型扫描条件清单举例如表3-1。
表3-1 典型扫描条件清单
|
序号
|
申报产品
|
同品种产品
|
|
第一组
|
成人头部PETCT扫描
扫描参数
扫描时间:
重建参数
重建算法:
FOV:
重建层厚:
矩阵:
…
|
成人头部PETCT扫描
扫描参数
扫描时间:
重建参数
重建算法:
FOV:
重建层厚:
矩阵:
…
|
|
第二组
|
成人体部PETCT扫描
扫描参数
扫描时间:
重建参数
重建算法:
FOV:
重建层厚:
矩阵:
…
|
成人体部PETCT扫描
扫描参数
扫描时间:
重建参数
重建算法:
FOV:
重建层厚:
矩阵:
…
|
|
…
|
…
|
…
|
注:模体试验所包括的所有图像性能试验,需要符合YY/T 0829要求,整个试验中不允许修改会对图像质量产生影响的图像处理软件。如果试验中需要调整,则需要重新开始试验所有的图像性能指标。
六、试验数据
在此列出各项指标的试验数据。
以图像复原系数试验为例,参照YY/T 0829标准对比新产品与已上市产品的性能差异。试验数据记录如下表3-2所示。
表3-2图像复原系数试验
|
性能指标
|
模体区域
|
同品种产品
|
申报产品
|
申报产品
是否更优
|
|
百分对比度
|
10mm
|
|
|
|
|
13mm
|
|
|
|
|
17mm
|
|
|
|
|
22mm
|
|
|
|
|
28mm
|
|
|
|
|
37mm
|
|
|
|
|
Lung肺区
|
|
|
|
|
百分本底变化率
|
10mm
|
|
|
|
|
13mm
|
|
|
|
|
17mm
|
|
|
|
|
22mm
|
|
|
|
|
28mm
|
|
|
|
|
37mm
|
|
|
|
|
Lung肺区
|
|
|
|
七、试验结论
在此汇总申报产品与同品种产品的各项试验指标的对比结果(不低于、低于),得出总体结论,试验指标及对比结果如表3-3。
表3-3模体试验结果
试验结论:申报产品所有性能指标不低于/低于同品种产品,可以形成临床评价报告/需要提供临床样本图像。
八、试验人员
需明确试验人员以及审核人员,并在报告中签名。给出试验日期和审核日期。
九、其它
数据报告内容需全面,参照指导原则[7,8]附录9开展。
附件4
人体影像确认报告模板
一、 产品概述
包括产品名称、型号、规格、注册人信息、适用范围(含应用部位)、临床协议。
二、 评价表
评价部位按照申报部位可包括头颈部、胸部(含心脏)、上腹部、盆腔等。
以申报头颈部为例,表格可用于评价单独的影像或评价使用某种技术后的影像质量差异。其中PET/CT1_1是指某机型的配置1,在临床协议1下拍摄的上述部位的临床影像;采用李克特(Likert)1-5分制量表评估临床影像质量。
此外,申请人也可根据产品需要进行人体图像确认的具体功能特点,制定合理的临床影像质量的评价标准。
头颈部临床影像质量评价表
|
评价内容
|
扫描条件
|
PET/CT1_1
|
PET/CT 1_2
|
PET/CT 1_...
|
符合性
|
|
医生1
|
医生2
|
评价结果
|
医生1
|
医生2
|
评价结果
|
医生1
|
医生2
|
评价结果
|
|
|
PET
|
1.显示大、小脑皮质的主要沟回
|
受试者类型:成人
部位:头颈部PET/CT扫描
扫描参数
扫描时间:
重建参数
重建算法:
FOV:
重建层厚:
矩阵:
…
|
|
|
|
|
|
|
|
|
|
|
|
2.显示基底节尾状核头、壳核、丘脑
|
|
3.显示灰质、白质区界限
|
|
4.显示侧脑室空白区
|
|
5.显示动眼肌
|
|
6.咽部结构
|
|
CT
|
1.显示脑沟、脑裂与蛛网膜下腔
|
|
|
|
|
|
|
|
|
|
|
|
2.显示脑室系统、脑池系统
|
|
|
|
|
|
|
|
|
|
|
|
3.显示下丘脑、脑干
|
|
|
|
|
|
|
|
|
|
|
|
4.显示灰质、白质、脑室密度界限
|
|
|
|
|
|
|
|
|
|
|
|
5.显示蝶鞍、筛窦、鼓室等骨细微结构
|
|
|
|
|
|
|
|
|
|
|
|
6.显示颅骨内、外板
|
|
|
|
|
|
|
|
|
|
|
|
7.显示眼内、眼眶、鼻腔及头皮软组织结构
|
|
|
|
|
|
|
|
|
|
|
|
8.颌面部肌肉结构
|
|
|
|
|
|
|
|
|
|
|
|
9.颈部淋巴结、甲状腺结构
|
|
|
|
|
|
|
|
|
|
|
|
10.真假声带
|
|
|
|
|
|
|
|
|
|
|
|
11.甲状软骨、勺状软骨、舌骨、气管
|
|
|
|
|
|
|
|
|
|
|
|
12.枕骨大孔、T1椎体、颈椎诸骨结构
|
|
|
|
|
|
|
|
|
|
|
|
融合
|
PET与CT信号可以区别
|
|
|
|
|
|
|
|
|
|
|
|
脑灰质、白质、脑室准确吻合
|
|
|
|
|
|
|
|
|
|
|
|
头皮轮廓准确吻合
|
|
|
|
|
|
|
|
|
|
|
三、总结
申请人提供由评价医生签字的小结报告,伦理意见以及知情同意书样稿,并附临床影像及医生的资质证明文件。
国家药监局器审中心关于发布医用X射线诊断设备(第三类)同品种临床评价注册审查指导原则的通告
为进一步规范医用X射线诊断设备(第三类)的管理,国家药监局器审中心组织制定了《医用X射线诊断设备(第三类)同品种临床评价注册审查指导原则》,现予发布。
特此通告。
附件:医用X射线诊断设备(第三类)同品种临床评价注册审查指导原则
国家药品监督管理局
医疗器械技术审评中心
2023年8月3日
附件
医用X射线诊断设备(第三类)同品种
临床评价注册审查指导原则
本指导原则旨在指导注册申请人对医用X射线诊断设备(第三类)开展同品种临床评价,同时也为技术审评部门审评医用X射线诊断设备(第三类)同品种临床评价资料提供参考。
本指导原则是对医用X射线诊断设备(第三类)同品种临床评价的一般要求,申请人需依据产品的具体特性确定其中内容是否适用。若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
本指导原则是供注册申请人和技术审评人员使用的指导性文件,但不包括审评审批所涉及的行政事项,亦不作为法规强制执行,需在遵循相关法规的前提下使用本指导原则。如果有能够满足相关法规要求的其他方法,也可以采用,但是需要提供详细的研究资料和验证资料。
本指导原则是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本指导原则的相关内容也将进行适时的调整。
一、适用范围
本指导原则适用于管理类别为III类的医用血管造影X射线机、移动式C形臂X射线机、透视摄影X射线机、口腔颌面锥形束计算机体层摄影设备、肢体锥形束计算机体层摄影设备。按现行《医疗器械分类目录》[1],上述产品分类编码均属于06-01。
其中,移动式C形臂X射线机、透视摄影X射线机均已列入《免于临床评价医疗器械目录(2021年)》[2](简称《目录》),本指导原则适用于《目录》以外的具有数字化体层摄影功能的移动式C形臂X射线机、透视摄影X射线机的同品种临床评价工作,具有数字化体层摄影功能的移动式O形/G形臂X射线机亦可参照本指导原则的适用要求进行临床评价。
本指导原则涉及的口腔颌面锥形束计算机体层摄影设备内容是对已发布《口腔颌面锥形束计算机体层摄影设备注册技术审查指导原则》[3]《口腔颌面锥形束计算机体层摄影设备临床评价技术审查指导原则》[4]相关内容的修订。
注册申请人需全面评价产品的硬件、软件的功能。考虑产品和功能的多样性,本指导原则仅就产品的医学影像质量,有针对性的提出和规范了临床评价要求。
若拟申报产品与境内已上市产品相比,某关键器件(含软件)具有全新的技术特性,或拟申报产品具有全新的临床适用范围,若不能通过非临床研究数据、人体影像样本数据等证据资料证明申报产品的安全性和有效性,注册申请人需要考虑通过临床试验来获得临床数据。
二、基本原则
注册申请人需遵循科学、客观的原则,根据申报产品实际情况确定临床评价路径,依据《医疗器械临床评价等同性论证技术指导原则》[5],提供相应的临床评价资料。
注册申请人通过同品种比对的方式开展临床评价,需针对拟申报产品和同品种产品之间的差异性,提供有效的科学证据,以评价差异性是否对申报产品的安全性和有效性产生不利影响。一般而言,差异性对图像质量的影响需提供实验室数据(如模体试验)等非临床研究数据,必要时需提供人体影像样本等数据予以确认。模体试验要求详见本指导原则第四章节,人体影像样本的确认要求详见本指导原则第五章节。
三、同品种临床评价
注册申请人可选择一个或多个同品种产品,并根据产品特征选择合适的对比项目,基于详实的研究结果,分析拟申报产品和同品种产品是否存在差异。对比项目包括但不限于附件1所述。
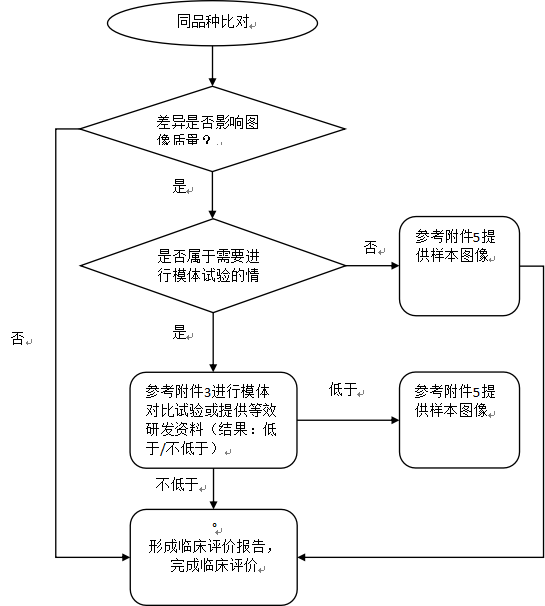
针对拟申报产品与同品种产品的差异,注册申请人需分析差异性是否对产品的安全性和有效性产生不利影响,将拟申报产品自身的数据作为支持性资料。注册申请人还需进一步评价差异是否影响图像质量,以及上述影响的程度和范围,必要时提供模体试验结果、人体影像样本数据进行确认。
若关键部件(如X射线管组件或X射线管、高压发生器、探测器、限束器等),或调整扫描参数(如新增管电压档位)等差异影响图像质量,注册申请人需开展相应模体试验,根据模体图像分析拟申报产品和同品种产品在成像性能方面的差异性。原则上,拟申报产品性能指标不应显著低于同品种产品。拟申报产品模体图像的性能指标不低于同品种产品时,则拟申报产品可视为符合预期的临床应用要求;拟申报产品模体图像的性能指标低于(全部或部分性能指标低于)同品种产品,注册申请人需要提供人体影像样本予以确认,或提供等效研究的临床文献和资料。
产品同品种评价路径详见附件2。
四、模体试验基本原则
模体试验需遵循以下原则:
(一)基本原则
注册申请人根据对比差异实施模体试验,模体试验方案需充分验证拟申报产品和同品种产品的差异性。
(二)试验目的
模体试验目的是获得拟申报产品与同品种产品图像质量/性能指标的比较。
以移动式C形臂X射线机为例,需至少评价三维成像空间分辨率,需在临床典型协议(以下简称协议)下进行评价。
(三)试验条件
拟申报产品和同品种产品的试验条件需一致;需在相同的协议下进行试验,选取的协议需具有可比性和合理性。
(四)试验方法
医用血管造影X射线机的模体试验可参考《YY/T 0740 医用血管造影X射线机专用技术条件》[6]第5.4、5.5章节,移动式C形臂X射线机的模体试验可参考《YY/T 0744 移动式C形臂X射线机专用技术条件》[7]第5.4.13章节,口腔颌面锥形束计算机体层摄影设备的模体试验参考《YY/T 0795 口腔颌面锥形束计算机体层摄影设备专用技术条件》[8],肢体锥形束计算机体层摄影设备、透视摄影X射线机的数字化体层摄影功能的模体试验具体要求由注册申请人制定。
(五)试验报告模板
模体试验报告模板见附件3。
五、人体影像确认基本原则
(一)评价对象
需基于人体的图像进行评价,注册申请人需说明获取的人体图像的具体信息,保证提供的图像的真实性。
(二)评价人员
医用血管造影X射线机需由符合其预期临床应用场景的医生阅片,如介入操作或放射科医生;
移动式C形臂X射线机需由符合其预期临床应用场景的医生阅片,如骨科医生;
口腔颌面锥形束计算机体层摄影设备需由符合其预期临床应用场景的医生阅片,如口腔放射科医生;
肢体锥形束计算机体层摄影设备需由符合其预期临床应用场景的医生阅片,如放射科或骨科医生;
透视摄影X射线机的数字化体层摄影功能需由符合其预期临床应用场景的医生阅片,如放射科或骨科医生。
需由有经验的医生阅片。
(三)评价部位影像数量
1.常规应用
医用血管造影X射线机的人体影像需覆盖申报的模式(透视、摄影、血管造影)及部位(如头部、心脏、腹部、四肢等)。其中,透视、摄影的影像数量不少于10幅,血管造影的影像数量不少于10幅,若申报冠脉,其冠脉模式下影像数量不少于10幅。总的影像数量不少于30幅[9]。
肢体锥形束计算机体层摄影设备的人体影像需覆盖申报的部位(如四肢),总的影像数量不少于10幅。
口腔颌面锥形束计算机体层摄影设备的人体影像样本量例数符合《口腔颌面锥形束计算机体层摄影设备临床评价技术指导原则》[4]相关章节内容。
2.特殊应用:数字化体层摄影功能
医用血管造影X射线机的人体影像需覆盖申报的血管、软组织,血管、软组织的影像数量各不少于10幅。总的影像数量不少于30幅[9]。
移动式C形臂X射线机的人体影像需覆盖申报的骨与关节(如脊柱、四肢等),总的影像数量不少于30幅[9]。
透视摄影X射线机的数字化体层摄影功能需覆盖申报的骨与关节、软组织等,总的影像数量不少于30幅[9]。
3.其它
若某部位影像可代表其它部位,注册申请人需结合临床意义进行详细说明,并针对该部位进行验证。
经分析仅影响到某部分部位或应用,验证影像数量需至少满足部分要求。
(四)阅片方式
申请人需至少采用双人独立评价的方式,若同一图像的两份评价结果不一致时,以较低评价为准;也可采用高水平第三人仲裁。若选用仲裁判定方式,需明确规定仲裁判定标准。
若由术中操作医生完成医用血管造影X射线机、移动式C形臂X射线机的图像质量评价,评价方式可考虑操作医生的独立评价。
(五)影像评估标准
医用血管造影X射线机的各部位影像评估标准参考《医用X射线诊断设备(第三类)注册技术审查指导原则(2016年修订版)》[10]相关章节内容,口腔颌面锥形束计算机体层摄影设备的各部位影像评估标准参考《口腔颌面锥形束计算机体层摄影设备注册技术审查指导原则》[3]相关章节内容。
用于术中的移动式C形臂X射线机的数字化体层摄影功能在骨科应用的各部位影像评估标准可参考附件4表1,用于临床常规检查的肢体锥形束计算机体层摄影设备的各部位影像评估标准可参考附件4表2,数字化体层摄影功能的血管部位影像评估标准、软组织影像评估标准可分别参考附件4表3、表4。
(六)影像评分量表
推荐使用李克特(Likert)量表评估图像质量。若采用1-3分制法,每份影像评分需不低于2分;若采用李克特(Likert)1-5分制法,每份影像评分需不低于3分。
以李克特三分法为例,若评价单独的影像,推荐使用表1格式进行评价,具体如下:
表1 影像评分表
|
评分
|
项目
|
|
3分
|
清晰可见
|
|
2分
|
可见
|
|
1分
|
不可见
|
若评价与境内已上市产品相比使用的某种新技术,需评价使用某种新技术前后的影像质量差异,推荐使用表2格式进行评价,具体如下:
表2 影像评分表
|
评分
|
项目
|
|
3分
|
使用某种技术后图像质量明显优于使用某种技术前图像质量,可用于诊断
|
|
2分
|
使用某种技术后图像质量基本等同于使用某种技术前图像质量,可用于诊断
|
|
1分
|
使用某种技术后图像质量低于使用某种技术前,图像质量差,不能诊断,不满意
|
(七)获取临床影像的条件
需覆盖所有配置,以及头部、心脏、腹部、四肢协议(不包括儿童),相关模板和要求详见附件5。
(八)伦理要求
人体影像确认研究(含获取人体图像的过程)需符合研究所在地法规的要求。对于造影检查,须严格执行相关要求和操作规程,做好处理抢救过敏及毒性反应的准备工作。
六、其它
若申报产品包含的某一软件功能模块曾跟随其它产品或作为独立软件在中国境内已上市,则申请人需评价该软件功能模块是否对申报产品的兼容性产生了影响。若评估无影响,申请人可提供该软件功能模块的境内上市证明性资料,包括注册证、产品技术要求、说明书相关章节等,并说明两者的实质等同性。
七、术语
数字化体层摄影是基于平板探测器技术与数字图像重建算法,生成目标组织的三维立体结构或多个断层影像的体层成像方法。
数字化体层摄影包括三维数字减影血管造影、三维成像、锥形束计算机体层摄影和断层融合摄影等技术,广泛应用于血管介入、疾病检查、术中成像等临床场景。
八、参考文献
[1]原国家食品药品监督管理总局.医疗器械分类目录:总局关于发布医疗器械分类目录的公告2017年第104号[Z].
[2]国家药品监督管理局.免于临床评价医疗器械目录:国家药监局关于发布免于临床评价医疗器械目录的通告2021年第71号[Z].
[3]原国家食品药品监督管理总局.口腔颌面锥形束计算机体层摄影设备注册技术审查指导原则:总局关于发布医用磁共振成像系统临床评价等4项医疗器械注册技术审查指导原则的通告2017年第6号[Z].
[4]国家药品监督管理局.口腔颌面锥形束计算机体层摄影设备临床评价技术指导原则:关于发布眼科高频超声诊断仪注册技术审查指导原则等4项指导原则的通告2019年第10号[Z].
[5]国家药品监督管理局.医疗器械临床评价等同性论证技术指导原则(2021):国家药监局关于发布医疗器械临床评价技术指导原则等5项技术指导原则的通告2021年第73号[Z] .
[6]YY/T 0740-2022,医用血管造影X 射线机专用技术条件[S].
[7]YY/T 0744-2018,移动式C形臂X射线机专用技术条件[S].
[8]YY/T 0795-2022,口腔颌面锥形束计算机体层摄影设备专用技术条件[S].
[9]Guidance for Industry and Food and Drug Administration Staff. Center for Devices and Radiological Health . [EB/OL].(2016-09-01)[2022-10-17].https://www.fda.gov/regulatory-information/search-fda-guidance-documents/guidance-submission-510ks-solid-state-x-ray-imaging-devices.
[10]原国家食品药品监督管理总局.医用X射线诊断设备(第三类)注册技术审查指导原则(2016年修订版):总局关于发布高频手术设备等6个医疗器械注册技术审查指导原则的通告2016年第21号.
附件1
申报产品与对比器械的对比表
|
序号
|
对比项目
|
申报产品
|
对比器械
|
差异性
|
支持性资料概述
|
|
1.基本原理
|
工作原理
|
|
|
|
|
|
2.结构组成
|
2.1
|
产品组成
|
|
|
|
|
|
2.2
|
核心部件
|
|
|
|
|
|
3.性能要求
|
3.1
|
性能参数
|
|
|
|
|
|
3.2
|
功能参数
|
|
|
|
|
|
4
|
软件核心功能
|
|
|
|
|
|
5.适用范围
|
5.1
|
适用人群
|
|
|
|
|
|
5.2
|
适用部位
|
|
|
|
|
|
5.3
|
具有数字化体层摄影功能
|
|
|
|
|
|
5.4
|
使用环境
|
|
|
|
|
|
6
|
禁忌证
|
|
|
|
|
|
7
|
防范措施和警告
|
|
|
|
|
附件2

附件3
模体试验报告模板
注:本指导原则以移动式C形臂X射线机为例列出本章节模板,本指导原则涉及的其它产品需根据产品自身特点及适用标准等要求自行完善模板。
一、试验方法概述
需概述模体试验的设计目的,并确认试验用设备的比对项目及结果符合产品宣称的指标要求。
二、参考标准
示例:
参照《YY/T 0744 移动式C形臂X射线机专用技术要求》。
三、试验指标
试验指标至少包括三维成像空间分辨率。
四、试验用仪器和体模
需给出仪器和体模的清单,包括其型号、编号。详细描述体模的技术参数,给出测试布局图。
五、试验条件
(一)工作条件
包括电源条件、温湿度和大气压等环境条件。
(二)扫描条件
在此列明拟申报产品与同品种产品的协议。
协议清单举例如表1所示。
表1 协议清单
|
序号
|
申报产品
|
同品种产品1
|
扫描剂量
|
|
第1组
|
脊柱扫描
管电压:100kV
管电流:aaa mA
旋转时间:1秒
扫描角度/次:360°
…
|
脊柱扫描
管电压:100kV
管电流:bbb mA
旋转时间:1秒
扫描角度/次:360°
…
|
…
|
|
第2组
|
脊柱扫描
管电压:80kV
管电流:aaa mA
旋转时间:1秒
扫描角度/次:360°
…
|
脊柱扫描
管电压:80kV
管电流:bbb mA
旋转时间:1秒
扫描角度/次:360°
…
|
…
|
|
…
|
…
|
…
|
…
|
注:模体试验所包括的所有图像性能试验,需要和临床使用条件一致,整个试验中不允许修改会对图像质量产生影响的图像处理软件。如果试验中需要调整,则需要重新开始试验所有的图像性能指标。
六、试验数据
在此列出各项指标的试验数据。
以三维成像空间分辨率试验为例,需在每个协议下进行扫描,试验数据记录如下表2所示。
表2 空间分辨率试验数据记录
|
试验条件
|
加载条件
|
试验
|
|
第1组 脊柱
|
协议1
|
…
|
|
协议2
|
…
|
|
协议3
|
…
|
|
第2组 脊柱
|
协议1
|
…
|
|
协议2
|
…
|
|
协议3
|
…
|
|
…
|
|
…
|
在此对试验数据进行分析,并说明分析方法。以三维成像空间分辨率试验为例,分析过程和结果见表3。
表3 空间分辨率对比
|
试验条件
|
试验对象
|
协议1
|
协议2
|
协议3
|
|
第1组 脊柱
|
申报产品
|
|
|
|
|
同品种产品
|
|
|
|
|
对比结果
|
不低于
|
不低于
|
不低于
|
|
第2组 脊柱
|
申报产品
|
|
|
|
|
同品种产品
|
|
|
|
|
对比结果
|
不低于
|
不低于
|
低于
|
|
…
|
…
|
…
|
|
…
|
七、试验结论
在此汇总拟申报产品与同品种产品的各项试验指标在每个协议下的对比结果(不低于/低于),得出总体结论,试验指标及对比结果如表4所示。
表4 模体试验结果汇总
|
试验指标
|
试验条件
|
对比结果
|
|
协议1
|
协议2
|
协议3
|
|
空间分辨率
|
第1组
空间分辨率
|
不低于
|
不低于
|
不低于
|
|
第2组
空间分辨率
|
不低于
|
不低于
|
低于
|
|
.
|
…
|
…
|
…
|
…
|
试验结论:申报产品第1组的成像性能不低于同品种产品,第2组的成像性能在协议3下的成像性能低于同品种产品。
八、试验人员
需明确试验人员以及审核人员,并在报告中签名。给出试验日期和审核日期。
附件4
各部位图像具体评估标准模板
表格1-移动式C形臂X射线机
|
部位
|
整体评分
|
图像质量评价标准
|
|
骨与关节
|
3分(图像质量优秀,非常满意)
|
骨、关节边缘和形态显示清晰;若有植入物,与骨、关节关键解剖标志相对位置整体显示清晰;未见伪影。
|
|
2分(图像质量有瑕疵,一般)
|
骨、关节边缘和形态显示尚可;若有植入物,与骨、关节关键解剖标志相对位置整体显示尚可;存在不影响术中操作的伪影。
|
|
1分(图像质量差,不满意)
|
骨、关节边缘和形态显示差;若有植入物,与骨、关节关键解剖标志相对位置整体显示差;存在影响术中操作的明显伪影。
|
表格2-肢体锥形束计算机体层摄影设备
|
部位
|
整体评分
|
图像质量评价标准
|
|
骨与关节
|
3分(图像质量优秀,可用于诊断,非常满意)
|
椎体:骨皮质、骨松质骨小梁结构显示清晰,椎小关节、椎管侧隐窝显示清晰,脊柱周围软组织显示清晰、层次分明;
椎间盘:椎间盘显示清晰;
关节:关节结构清晰可辨,骨皮质、骨松质骨小梁结构显示清晰;
图像对比度好;未见伪影。
|
|
2分(图像质量有瑕疵,不影响诊断,一般)
|
椎体:骨皮质、骨松质骨小梁结构显示尚可,椎小关节、椎管侧隐窝显示尚可,脊柱周围软组织显示尚可、层次尚分明;
椎间盘:椎间盘显示尚可;
关节:关节结构显示尚可,骨皮质、骨松质骨小梁结构显示尚可;
图像对比度尚可;有伪影。
|
|
1分(图像质量差,不能诊断,不满意)
|
椎体:骨皮质、骨松质骨小梁结构显示差,椎小关节、椎管侧隐窝显示差,脊柱周围软组织显示差、层次不清;
椎间盘:椎间盘显示不清;
关节:关节结构显示不清,骨皮质、骨松质骨小梁结构显示不清;
图像对比度差;明显伪影。
|
表格3-数字化体层摄影功能在血管的应用
|
部位
|
整体评分
|
图像质量评价标准
|
|
血管
|
3分(图像质量优秀,可用于诊断,满意)
|
血管轮廓清晰,正常分支小动脉(3级)显示完全。
|
|
2分(图像质量有瑕疵,不影响诊断,一般)
|
血管轮廓较清晰;正常分支小动脉(3级)显示基本完全。
|
|
1分(图像质量差,无法诊断)
|
血管边缘不清晰;正常分支小动脉(3级)显示不完全。
|
注:数字化体层摄影功能在血管上的临床应用目前主要应用于心脑血管。
表格4-数字化体层摄影功能在软组织的应用
|
部位
|
整体评分
|
图像质量评价标准
|
|
软组织
|
3分(图像质量优秀,可用于诊断,满意)
|
图像清晰;对比度好;无伪影或轻微伪影,能很好的满足介入手术需要。
|
|
2分(图像质量有瑕疵,不影响诊断,一般)
|
图像尚清晰;对比度尚可;图像有少量伪影但不影响对病变或解剖结构的观察及诊断;能基本满足介入手术需要。
|
|
1分(图像质量差,无法诊断)
|
图像清晰度、对比度均较差;伪影较大,影响对病变或解剖结构的观察及诊断;不能满足介入手术需要。
|
注:数字化体层摄影功能在软组织上的临床应用目前主要用于识别软组织结构或病变轮廓,以及显示软组织中的高对比度组织,不用于软组织的常规检查诊断。
附件5
人体影像样本确认报告模板
三、 产品概述
包括产品名称、型号、规格、注册人信息、适用范围(含应用部位)、协议。
四、 评价表
评价部位按照申报部位可包括脑部、冠脉、骨与关节等。
以医用血管造影X射线机的数字化体层摄影功能在心血管的应用为例,以下表格供参考。表格可用于评价单独的影像或评价使用某种技术后的影像质量差异,其中DSA1_1是指某机型的配置1,在典型模式1下拍摄的覆盖上述部位的临床影像;采用李克特(Likert)1-3分制量表评估临床影像质量。
此外,注册申请人也可根据产品需要进行临床评价的具体功能特点,制定合理的临床影像质量的评价标准。
临床影像质量评价表
|
评价内容
|
协议
|
DSA1_1
|
DSA 1_2
|
DSA...
|
符合性
|
|
医生1
|
医生2
|
评价结果
|
医生1
|
医生2
|
评价结果
|
医生1
|
医生2
|
评价结果
|
|
|
血管造影
|
主动脉
|
受试者类型:成人
管电压: kV
管电流: mA
曝光时间: ms
…
|
|
|
|
|
|
|
|
|
|
|
|
冠状动脉
|
|
器官脏器
|
五、 总结
注册申请人提供由评价医生签字的小结报告、伦理意见以及知情同意书样稿,并附临床影像及医生的资质证明文件。
国家药监局器审中心关于发布血液透析浓缩物临床评价注册审查指导原则的通告
为进一步规范血液透析浓缩物医疗器械的管理,国家药监局器审中心组织制定了《血液透析浓缩物临床评价注册审查指导原则》,现予发布。
特此通告。
附件:血液透析浓缩物临床评价注册审查指导原则
国家药品监督管理局
医疗器械技术审评中心
2023年8月3日
附件
血液透析浓缩物临床评价注册审查指导原则
本指导原则旨在指导注册申请人对血液透析浓缩物开展临床评价,同时也为技术审评部门审评血液透析浓缩物临床评价资料提供参考。
本指导原则是对血液透析浓缩物临床评价的一般要求,申请人应依据产品的具体特性确定其中内容是否适用。若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
本指导原则是供注册申请人和技术审评人员使用的指导性文件,但不包括审评审批所涉及的行政事项,亦不作为法规强制执行,应在遵循相关法规的前提下使用本指导原则。如果有能够满足相关法规要求的其他方法,也可以采用,但是需要提供详细的研究资料和验证资料。
本指导原则是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本指导原则的相关内容也将进行适时的调整。
一、 适用范围与基本信息
本指导原则适用于对急慢性肾功能衰竭患者进行血液透析或血液透析滤过治疗时使用的血液透析浓缩物。
血液透析浓缩物通常由A剂和B剂组成,临床使用时按照说明书规定的A剂、B剂与透析用水的配合比例使用。按现行《医疗器械分类目录》,血液透析浓缩物分类编码为10-04-01,管理类别为III类。
A剂通常为酸性血液透析浓缩物,一般由氯化钠、氯化钾、氯化钙、氯化镁、冰醋酸(或枸橼酸)等组成。B剂为碳酸氢盐血液透析浓缩物,一般由碳酸氢钠或碳酸氢钠加氯化钠组成。血液透析浓缩物常见供给状态是液体或粉剂。粉剂包括普通粉剂和在线使用联机B干粉两种,前者需要溶解形成浓缩液后使用,后者在配套使用的透析机上直接溶解并与A剂及透析用水混合生成透析液使用。在线使用联机B干粉产品通常仅包含碳酸氢钠一种成分。
还可根据血液透析浓缩物配制成的透析液成分或离子浓度不同分为不同类型,例如根据钙离子浓度的不同分为高钙(1.75mmol/L)、普通钙(1.5 mmol/L)、低钙(1.25 mmol/L)等不同类型;根据是否含葡萄糖分为含糖、不含糖血液透析浓缩物;根据酸性浓缩物中酸根离子不同,可分为醋酸盐透析浓缩物、枸橼酸盐透析浓缩物等。
二、同品种临床评价的基本要求
(一)同品种医疗器械的选择
注册申请人需选择与申报产品适用范围相同,产品配方(如酸根离子)、终离子浓度(如高钙、普通钙、低钙)、供给状态和产品性能最为相似的产品作为同品种医疗器械。
(二)适用范围的对比
申报产品与同品种器械适用范围需相同,通常为用于急慢性肾功能衰竭患者的血液透析或血液透析滤过治疗。
若申报产品为在线使用联机B干粉,注册申请人需明确配用透析机机型等信息。
(三)技术特征的对比
针对申报产品,注册申请人需将产品基本信息、产品性能等方面的信息与同品种器械进行比对,以证明申报产品具有相同的安全有效性。建议重点考虑以下内容,包括但不限于:
1.产品基本信息
注册申请人需明确申报产品与同品种医疗器械A剂、B剂的供给状态(液体/粉剂)、A剂、B剂与透析用水的混合比例、型号规格及装量。若申报产品的A剂、B剂均存在多个型号规格,应明确型号规格之间的配用关系。
2.产品重要性能指标
需对比申报产品和同品种器械的重要性能指标,包括但不限于A剂和B剂各自的组成成分、各成分含量(如A剂和B剂为液体,则比较各成分的溶质浓度)、按照配用比例配制成透析液后的终离子浓度和pH值等。终离子浓度和pH值等重要性能指标需比较在相同测试条件下的具体检测数值,且终离子浓度需比较要求值的范围(即比较终离子浓度的上下限)。
(四)差异部分的安全有效性证据
若申报产品pH值、终离子浓度等性能指标与同品种医疗器械存在差异,注册申请人可通过增加同品种医疗器械,以论证申报产品的安全有效性,例如:
注册申请人如果选择适用范围、技术特性等与申报产品基本相同的医疗器械A作为同品种医疗器械,除醋酸根离子浓度不同外,其他成分及终离子浓度均相同,需考虑增加具有相同酸根离子的产品作为同品种医疗器械B。但同时需考虑增加同品种医疗器械而引入的新的差异性,如同品种医疗器械B的pH值等可能与申报产品不同或差异离子与其他离子的适配性不同等,需对差异部分进行分析,结合临床使用经验及已上市同类产品的情况,说明差异部分的临床可接受性。
若注册申请人选择适用范围、技术特性等与申报产品基本相同的医疗器械A作为同品种医疗器械,但某个离子浓度的标称值及允差存在差异,如申报产品某个离子浓度上限高于同品种医疗器械,可通过已上市同类产品的数据证明申报产品该离子浓度上下限仍在已获批产品的范围内。
若为在线联机使用B干粉,需在配套使用的透析机上直接溶解并与A剂及透析用水混合生成透析液使用,可能存在溶解不完全或不稳定的问题,因此,针对在线使用联机B干粉,除上述要求外,还需验证申报产品的联机使用性能,在线使用联机B干粉产品应检测其联机使用性能,至少按产品说明书规定的临床适用机型、使用方式和最长使用时间,采用联机配制的方法配制透析液,从透析开始至透析结束,根据最长使用时间平均分配取样时间点(至少四个时间点),分别取各时间点制成的透析液作为检验液,检测pH值、溶质浓度。如存在联机袋、联机桶不同包装,以及最长使用时间有区别时,应分别进行检验。
(五)同品种医疗器械的临床数据
同品种医疗器械的临床数据包括临床试验数据(如适用)、临床经验数据和临床文献数据。建议注册申请人关注血液透析浓缩物产品相关不良事件发生数据,如败血症、热原反应、急性溶血等,充分识别申报产品的相应风险,并确认其是否已得到合理控制,必要时在说明书中补充相应注意事项与警示信息。
三、临床试验的基本要求
若申报产品具有全新的组成成分、终离子浓度或申报产品具有全新的适用范围,或已有数据无法证明申报产品差异部分安全有效性的,需提交申报产品的临床试验数据。
临床试验可参考《医疗器械临床试验设计技术指导原则》进行设计,若在境内开展临床试验,需符合《医疗器械临床试验质量管理规范》的要求,参考《医疗器械临床评价报告技术指导原则》编制临床评价报告。在此基础上,结合该类产品已知的适用范围和设计特征,对临床试验设计提出以下建议,以下建议不能覆盖血液透析浓缩物的所有情形和未知情形。
(一)临床试验设计类型
建议选择随机、盲法(如适用)、平行对照的临床试验设计,可选用非劣效、优效、等效的比较类型。
(二)试验人群
根据申报产品预期使用的目标人群,确定研究的总体。对于该类产品已知的适用范围和设计特征,受试者通常为需进行血液透析治疗的慢性肾功能衰竭患者,处于稳定的维持性透析状态,如透析治疗每周3次、每次不少于4小时,维持至少3个月以上的患者。
(三)临床评价指标
试验设计的各项指标需能够正确反映透析过程中的治疗作用和安全性问题,如电解质和酸碱平衡。
主要评价指标可包括透析前、后K+、Na+、Ca2+、Cl-、CO2CP(二氧化碳结合力)或HCO3-、pH值的达标率(注册申请人需规定“达标”的定义并说明确定依据);次要观察指标可包括透析前、后肌酐、尿素氮的下降率,以及透析前、后各离子浓度的检测值。如配方包含葡萄糖等成分,建议增加对应成分及预期使用效果的观察项目。
安全性评价项目可包括相关临床症状(如有无恶心、呕吐、头痛、抽搐);生命体征指标(脉搏、血压、呼吸);肝功能检查(ALT、AST、ALB);血常规检查(PLT、WBC、HGB);炎症状态指标(CRP)及临床试验过程中出现的其他异常现象等。针对安全性评价指标,应提供透析前后的具体检测数值,并提供统计学描述及分析。安全性指标如出现异常且有临床意义的情形,需明确原因,记录患者有无出现相关的不良事件,论述此种情形是否可接受。
此外,注册申请人需在临床试验报告中记录所有不良事件,包括发生时间、发生原因、处理措施及处理结果,分析不良事件与试验用器械的关系,论述不良事件是否可接受。
(四)样本量计算
样本量以临床试验的主要评价指标进行估算,样本量估算时,申请人需充分论述样本量计算参数的确定依据。样本量计算的相关要素包括临床试验的设计类型和比较类型、主要评价指标的类型和定义、主要评价指标有临床实际意义的界值、主要评价指标的相关参数(如预期达标率等)、Ⅰ类和Ⅱ类错误率以及预期的受试者脱落和方案违背的比例等。
例如:当选择随机、对照、非劣效性临床试验设计时,如选择达标率(“达标”的受试者人数/受试者总人数×100%,将“达标”定义为经过一次透析后,K+、Na+、Ca2+、Cl-、CO2CP(二氧化碳结合力)或HCO3-、pH值等均达到预先设定临床数值)为主要评价指标,假设对照产品透析达标率为98%,预计试验器械与对照器械的透析达标率相当,临床认可的非劣效界值为5%,则在显著性水平0.05(双侧)、80%把握度、考虑5%脱落率的情况下,每组需要130例受试者,两组共需要260例受试者。
四、参考文献
[1]国家药品监督管理局.医疗器械临床评价技术指导原则:国家药监局关于发布医疗器械临床评价技术指导原则等5项技术指导原则的通告2021年第73号[Z] .
[2]国家药品监督管理局.医疗器械临床评价等同性论证技术指导原则(2021):国家药监局关于发布医疗器械临床评价技术指导原则等5项技术指导原则的通告2021年第73号[Z] .
[3]国家药品监督管理局.决策是否开展医疗器械临床试验技术指导原则(2021):国家药监局关于发布医疗器械临床评价技术指导原则等5项技术指导原则的通告2021年第73号[Z] .
[4]国家药品监督管理局.医疗器械注册申报临床评价报告技术指导原则(2021):国家药监局关于发布医疗器械临床评价技术指导原则等5项技术指导原则的通告2021年第73号[Z] .
[5]原国家食品药品监督管理总局. 医疗器械临床试验设计指导原则(2018):原国家食品药品监督管理总局通告2018年第6号[Z].
[6]原国家食品药品监督管理总局. 血液透析浓缩物产品注册技术审查指导原则:原国家食品药品监督管理总局通告2014年第6号[Z].
[7] 原国家食品药品监督管理总局.医疗器械分类目录: 原国家食品药品监督管理总局公告2017年第104号[Z].
[8] 国家药品监督管理局,国家卫生健康委员会.医疗器械临床试验质量管理规范: 国家药品监督管理局 国家卫生健康委员会2022年第28号[Z].
[9]王质刚.血液净化学(第4版)[M].北京:北京科学技术出版社, 2016.
来源:CMDE
【文章内容与信息来源于互联网或转载,我公司不对本文所包含内容的准确性、可靠性或者完整性提供任何明示或暗示的保证,不对本文观点负责。如转载内容涉及版权等问题,请立即与我们联系,我们将迅速采取适当措施,以保障双方权益,谢谢。】
注:文章配图为网络转载图片,侵权即删!