医疗器械飞行检查情况通告 (2020年第2号)
为加强医疗器械监督管理,保障医疗器械安全有效,依据《医疗器械监督管理条例》《医疗器械生产监督管理办法》《药品医疗器械飞行检查办法》《医疗器械生产质量管理规范》及相关附录,以及《食品药品监管总局关于印发医疗器械生产质量管理规范现场检查指导原则等4个指导原则的通知》(食药监械监〔2015〕218号)等要求,按照国家药品监督管理局2020年医疗器械检查工作部署,核查中心于2020年8月-9月组织开展了医疗器械生产企业飞行检查工作, 发现山东瑞安泰医疗技术有限公司等企业存在不符合《医疗器械生产质量管理规范》及相关附录的问题。具体情况见附表。
针对检查中发现的问题,相关省(自治区、直辖市)药品监督管理局应责成企业限期整改,要求企业评估产品安全风险,对有可能导致安全隐患的,应按照《医疗器械召回管理办法》的规定召回相关产品。企业完成整改后,相关省药品监督管理局应及时组织跟踪复查,并将跟踪复查情况及时报送国家药品监督管理局食品药品审核查验中心。
附件:核查中心2020年第二批医疗器械飞行检查情况汇总
国家药监局核查中心
2020年10月10日
核查中心2020年第二批医疗器械飞行检查情况汇总

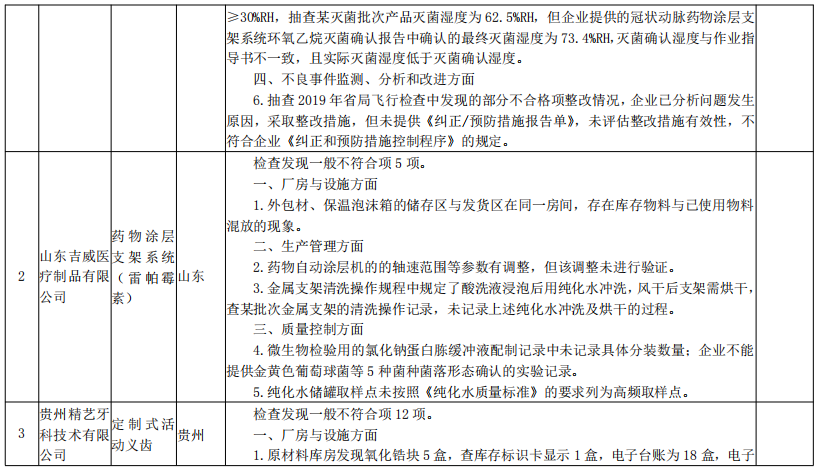

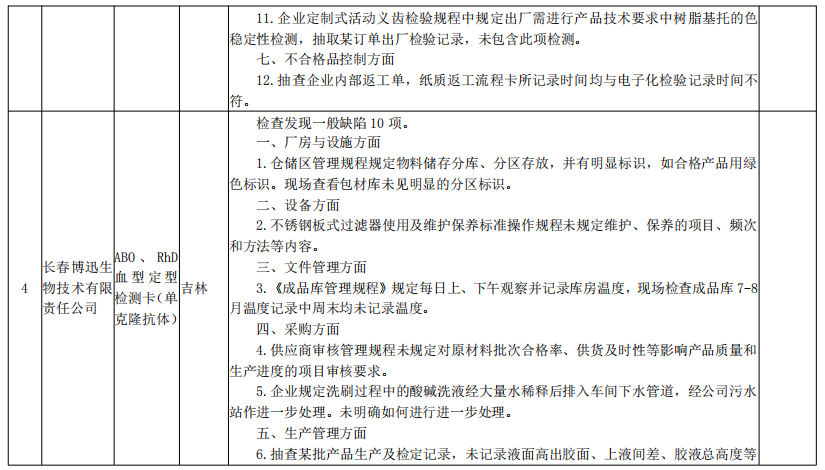
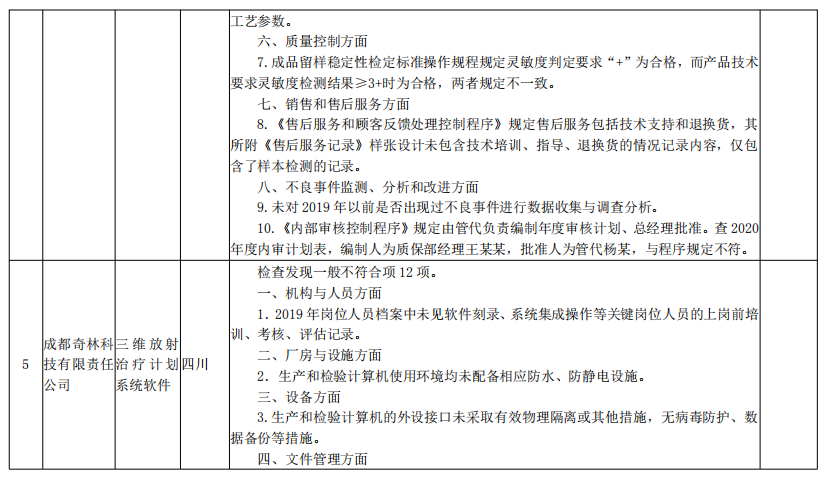

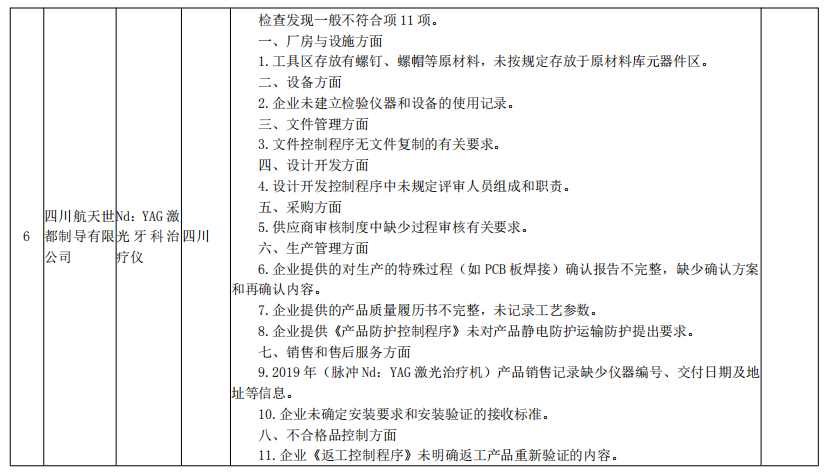


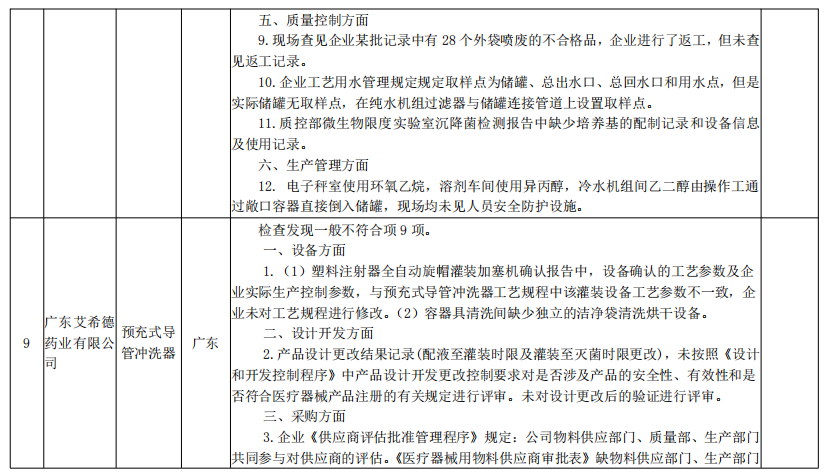


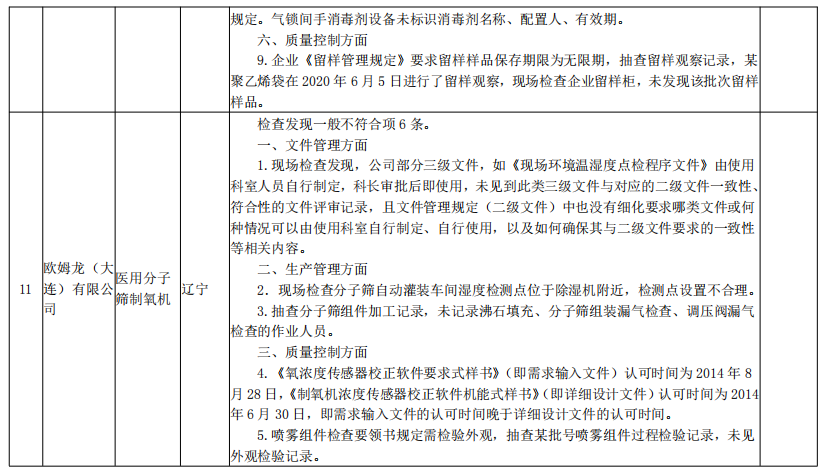

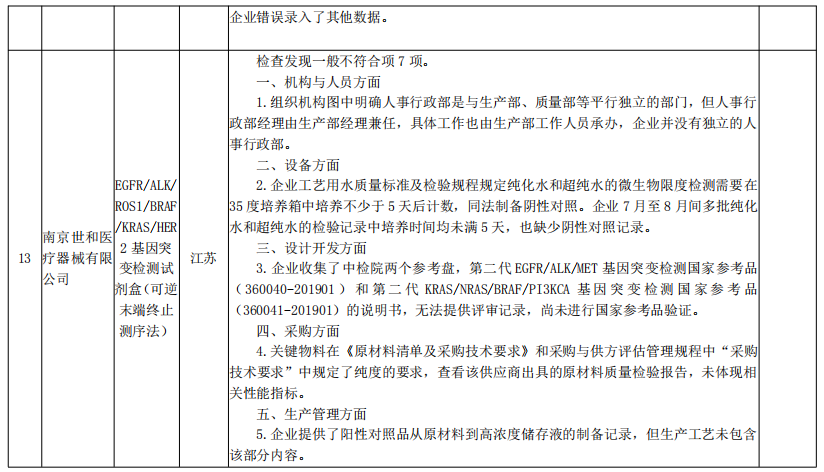

来源:国家药监局核查中心
【本文内容为转载,我公司不对本文所包含内容的准确性、可靠性或者完整性提供任何明示或暗示的保证,不对本文观点负责。如转载内容涉及版权等问题,请立即与我们联系,我们将迅速采取适当措施,以保障双方权益,谢谢。】