GMP飞检高频问题汇总,对应条款看案例!
GMP飞检像极了器械生产企业的考试,即使你与判卷人拿着同一份《医疗器械生产质量管理规范》,还是不确定自己的理解与判卷人的给分标准之间到底差了几个“一般缺陷”几个“严重缺陷”。想要逢检必过,先来看看被检查的企业都折在了哪吧:
停产整改最多的原因
2018年药监局飞检案例,汇总了企业被检出问题最多的7条:
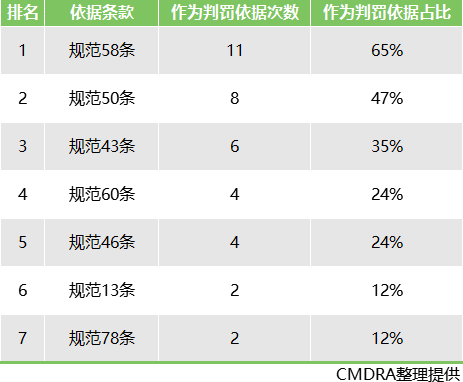
飞检高频问题分析
TOP1,《规范》第58条
第五十八条:企业应当根据强制性标准以及经注册或者备案的产品技术要求制定产品的检验规程,并出具相应的检验报告或者证书。
需要常规控制的进货检验、过程检验和成品检验项目原则上不得进行委托检验。对于检验条件和设备要求较高,确需委托检验的项目,可委托具有资质的机构进行检验,以证明产品符合强制性标准和经注册或者备案的产品技术要求。
【案例1】(国家总局通告2015年第77号)沈阳东亚医疗研究所有限公司,未按规定对成品进行机械性能项目检测;
【案例2】(国家局2016年05月09日发布)汕头市金丰医疗器械科技有限公司,企业未制定《成品检验规则》;查阅一次性惰气保护真空采血管(规格型号12×100mm)《成品检验报告》(生产批号150723)中采血管容量及采血管泄露检验方法未按《粤械注准20152410516一次性惰气保护真空采血管产品技术要求》规定的按YY0314附录B及附录C进行试验;
【案例3】(国家总局通告2015年第77号)沈阳东亚医疗研究所有限公司,未按规定对产品所用钛板原料检验进行弯曲性能检测;
【案例4】(国家局2016年05月09日发布)汕头市金丰医疗器械科技有限公司,《半成品检验作业规程》(文件编号WI-13A)中各检验项目的检验依据YZB/粵0259-2003已废止,试管高温消毒、生产过程真空度检验等抽验方法及判定规则描述不清;
TOP2,《规范》第50条
第五十条 每批(台)产品均应当有生产记录,并满足可追溯的要求。
生产记录包括产品名称、规格型号、原材料批号、生产批号或者产品编号、生产日期、数量、主要设备、工艺参数、操作人员等内容。
【案例1】(国家局2016年04月26日发布)江西富尔康实业集团有限公司,企业批号为20150314的采血管,生产记录上显示批数量为6000支,在成品检验和留样抽取100支后,入库数量还为6000支,记录存在不一致情况;
TOP3,《规范》第43条
第四十三条 采购时应当明确采购信息,清晰表述采购要求,包括采购物品类别、验收准则、规格型号、规程、图样等内容。应当建立采购记录,包括采购合同、原材料清单、供应商资质证明文件、质量标准、检验报告及验收标准等。采购记录应当满足可追溯要求。
【案例1】(国家局2016年04月26日发布)江西富尔康实业集团有限公司,一次性使用真空采血管过程检验规程(FEK-QC-BJY-C09,B/0)中未清晰表述原材料添加剂的进货检验要求和接受准则;企业制定了采血管添加剂进货检验规程(FEK-QC-YJY-034),但实际检验方式为采购验证,与进货检验过程不一致;
【案例2】(国家局2016年04月26日发布)辽宁开普医疗系统有限公司,采购合同中未清晰表述采购的相关要求,如谱仪中PCD线路板的防静电包装要求、标识要求等;
【案例3】(国家局2016年05月09日发布)汕头市金丰医疗器械科技有限公司,查阅2016年3月4日采购江阴市鸿萌橡塑制品厂生产的丁基胶塞的采购资料,未按《采购控制程序》(QP-09)规定进行申购审批;
TOP4,《规范》第60条
第六十条 企业应当规定产品放行程序、条件和放行批准要求。放行的产品应当附有合格证明。
【案例1】(国家局2018年08月20日发布)江苏省博朗森思医疗器械有限公司,《产品放行、交付和防护控制程序》对产品、成品、物资、原材料、化学试剂、外购(外协)件的放行条件和准则不明确;《一次性腹腔镜圆形吻合器成品检验规程》关于成品检验、过程检验、产品出厂检验的项目指标规定不明确;
SHAPE \* MERGEFORMAT
TOP5,《规范》第46条
第四十六条 企业应当编制生产工艺规程、作业指导书等,明确关键工序和特殊过程。
【案例1】(国家局2016年05月09日发布)汕头市金丰医疗器械科技有限公司,未制定受控的关键和特殊过程的作业指导书,且对关键和特殊过程的重要参数未进行验证或确认;
TOP6,《规范》第13条
第十三条 厂房与设施应当根据所生产产品的特性、工艺流程及相应的洁净级别要求合理设计、布局和使用。生产环境应当整洁、符合产品质量需要及相关技术标准的要求。产品有特殊要求的,应当确保厂房的外部环境不能对产品质量产生影响,必要时应当进行验证。
【案例1】(国家局2016年04月26日发布)江西富尔康实业集团有限公司,企业将非无菌真空采血管的生产环境规定为10万级净化等级,但生产车间地面有裂缝,顶部边角有缝隙;换鞋区域未进行物理隔离或明确标识,存在交叉污染风险;
TOP7,《规范》第78条
第七十八条 企业应当定期开展管理评审,对质量管理体系进行评价和审核,以确保其持续的适宜性、充分性和有效性。
【案例1】(国家局2016年05月09日发布)汕头市金丰医疗器械科技有限公司,企业无定期对产品质量及质量管理工作进行审核,评审和评价的记录;
来源:CMDRA
【本文内容为转载,我公司不对本文所包含内容的准确性、可靠性或者完整性提供任何明示或暗示的保证,不对本文观点负责。如转载内容涉及版权等问题,请立即与我们联系,我们将迅速采取适当措施,以保障双方权益,谢谢。】