医疗器械注册与备案
应积极推进"减证便民"
近年来,党中央、国务院高度重视服务型政府转变,不断推进"放管服"改革积极落地。2018年5月,中办、国办印发《关于深入推进审批服务便民化的指导意见》,提出"减证便民"行动的工作要求。各级政府和部门不断推进证明事项清理工作,取得了良好效果。
今年4月28日,国家药品监管局发布了《关于取消36项证明事项的公告》,其中涉及医疗器械证明事项的有"取消医疗器械网络销售信息备案""申请境内第二、三类医疗器械生产许可证及医疗器械经营许可证遗失补发改为告知承诺"。目前,我国医疗器械申报分为行政审批事项和备案事项两类,本文对这两类事项所需的申报材料进行了梳理,并参考我国各地证明事项清理工作的进展,对医疗器械注册与备案证明事项清理方式与方法提出建议。
证明事项申报材料梳理
从国家层级行政审批事权来看,医疗器械注册主要分为产品注册与临床试验审批两类,产品注册包括国产第三类医疗器械注册及进口第二类、第三类医疗器械注册。国家药监局医疗器械技术审评中心依据相关法律法规对产品注册及临床试验申报材料进行形式审查。医疗器械、体外诊断试剂及第三类高风险临床试验审批申报材料见表1。
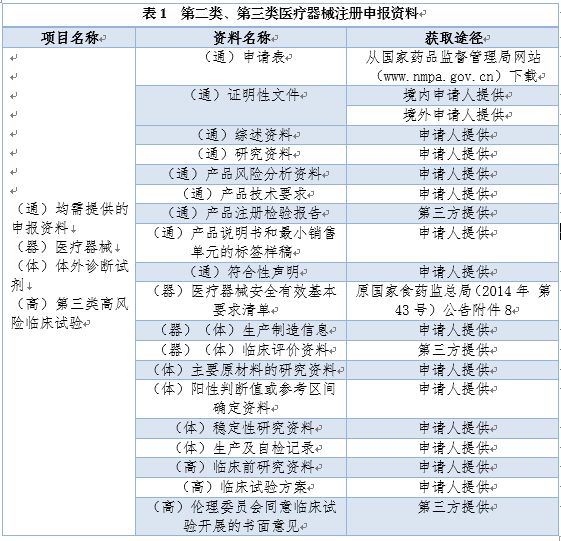
此外,医疗器械延续注册,还应提供产品无变化声明、历史注册证明、注册有效期内产品分析报告,以及技术要求变更材料等;变更申报则需提供相应的资质变更证明。体外诊断试剂延续注册与变更注册申报要求与医疗器械一致。
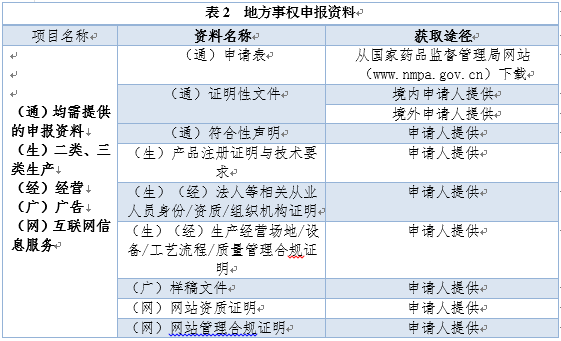
医疗器械行政审批的地方事权主要分为产品注册、生产经营许可、互联网信息服务及广告审批四类,由省、自治区、直辖市药品监管部门审评查验中心,以及各市的市场监管部门审评中心依据相关法律法规进行审核查验。第二类医疗器械/体外诊断试剂产品注册申报材料与表1一致,其他审批事项申报材料见表2。
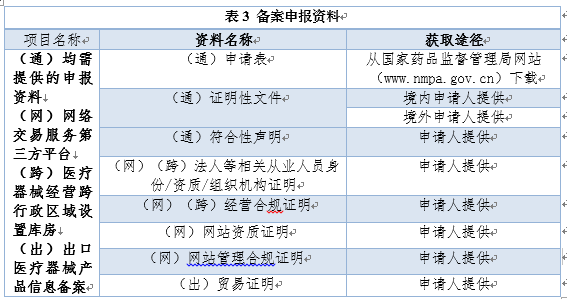
备案事项主要包括产品备案、生产经营备案、临床试验备案、网络交易服务备案、产品出口备案、异地设立库房备案等。其中产品备案、生产经营备案、临床试验备案所需申报材料与行政审批申报材料相同,网络交易服务备案、产品出口备案、医疗器械经营跨行政区域设置库房备案等申报材料见表3。
广义的证明事项可以理解为申请人提交所有证明性的申报材料;狭义的证明事项也可理解为第三方或政府机关为申请人出具的证明材料,如主体经营资格、检验报告等。以获取途径分类,申报材料可分为审批部门提供、申请人提供、第三方提供三类。审批部门提供申报材料包括申请表、安全有效性清单等;申请人提供的材料包括主体资质证明、从业人员身份及资格证明、产品相关材料以及研发生产经营相关材料等;第三方提供材料包括第三方机构审查核准审批意见、检验报告及预评价意见等。
各地证明事项清理分析
目前由司法部牵头,全国各级政府和部门正在全面开展证明事项清理工作。据不完全统计,今年1月,司法部发文取消证明事项28项,工信部发文取消证明事项38项,广东省发文取消证明事项1099项,河北省发文取消证明事项61项,海南省发文取消证明事项6项,福建省发文取消证明事项15项;3月,国家税务总局发文取消证明事项15项,青海省发文取消证明事项102项;4月,教育部发文取消证明事项22项,民政部发文取消证明事项24项,武汉市发文取消证明事项16项……
根据地方清理工作公告内容,笔者对上述涉及被清理的证明事项进行分析发现,被清理的证明事项类型包括以下6类:1.可以由其他材料替代证明,无须第三方再次开具的;2.可以通过发协查函、网络核查、内部核查、部门信息共享等方式核验的;3.取消原证明事项,改为告知承诺制的;4.直接取消的无实际意义证明的;5.无须提供纸质证明,改为电子材料证明的;6.无法律法规依据的。清理的方式主要为变更、消除、告知、减少、优化5种。其中1类出现91次,被清理率为6.28%;2类出现514次,被清理率为35.6%;3类出现295次,被清理率为20.42%;4类出现484次,被清理率为33.51%;5类出现8次,被清理率为0.52%;6类出现53次,被清理率为3.66%。(注:文中所收集信息均采集自中国政府网http://www.gov.cn/及相关公告,数据整理结果以实际为准,仅供参考。)
医疗器械证明事项优化建议
证明事项清理的意义在于为人民群众提供更便利、更快捷、更优质的政府服务,同时也是倒逼政府各部门互联互通、打破信息孤岛、切实向服务型行政管理转变、促进监管效能提升的有效措施。
2018年6月,国务院办公厅印发《关于做好证明事项清理工作的通知》,其中明确提出两个原则,一是没有法律法规规定的证明事项一律取消;二是对可以通过法定证照、书面告知承诺、政府部门内部核查和部门间核查、网络核验、合同凭证等办理的,能被其他材料涵盖或者替代的,开具单位无法调查核实的,以及不适应形势需要的,要提出取消建议。
具体来说,被清理证明事项应为以下内容:一是无法律法规规定,规章、规范性文件自行设定要求提供的证明材料;二是审核意义不大,或原提交仅为审核机构备存的,证明内容对审批资质没有实质影响的,事后可以由申请人自行留存备查的证明材料;三是通过内外部主动核查、部门间信息共享,或者可以间接证明的证明材料;四是已经对外公示,能够通过公共信息渠道查询、网络核验的证明材料;五是申请人实际难以取得,且可以通过其他渠道核查、自我保证声明、书面告知承诺等方式备查的证明材料;六是专门通过第三方取得,事后行政行为中会经常性重复的证明材料;七是有明显的其他申请材料可以替代,基本内容属于重复性证明的证明材料。综上所述,证明事项清理的基本原则为便民为主、事前承诺、事后核准、信息共享、化繁为简、互利互通。
参照上述原则,笔者对医疗器械证明事项优化提出三点建议:一是从便民角度出发,对各部门审核阶段重复需求提供的证明事项、内容重复的证明材料、可通过公开/非公开信息共享以及部门协查核验获取的材料予以优化、减少、变更、消除证明材料提供,如身份证明、资质证明、审核证明、信用证明等;二是可由国家药品监管部门牵头,逐步建立统一标准的数据库,打通证明堵点,对在其他审批或者备案事项申报中已经提交过的证明事项予以优化,实现证明事项均可互认,已在其他事项申请时进行公证的材料,无须再次公证、认证、转递;三是对证明意义不大、不符合现代管理要求,或者依据逻辑关系符合常理的证明事项,可使用告知承诺制予以衔接。
具体可通过网上身份认证、电子资质证书查证、电子签名、电子文书归档等方式,优化企业申报资料中的证明性文件、资质证明文件、合规性文件等非国家秘密、商业秘密的证明材料提供。此外,从资料准备工作和筹备成本来看,以电子查证、电子归档等方式进行审核,有利于降低企业资料审查错误率,提高形式审查效率,并有效降低整体行业申报成本,实现标准化、无纸化、无人化审查工作。
附录内容包含:
1.我国医疗器械行政审批事项;
2.我国医疗器械备案事项
3.涉及法律法规等相关依据
4.第二、三类医疗器械注册申报资料,第一类医疗器械备案申报资料详解
5.第三类高风险医疗器械临床试验审批申报资料详解
6.医疗器械生产许可/备案申报材料详解
来源: 中国健康传媒集团-中国食品药品网
【本文内容为转载,我公司不对本文所包含内容的准确性、可靠性或者完整性提供任何明示或暗示的保证,不对本文观点负责。如转载内容涉及版权等问题,请立即与我们联系,我们将迅速采取适当措施,以保障双方权益,谢谢。】