机器人支气管镜系统应用的研究进展及其与人工智能结合的展望
摘 要
机器人支气管镜系统是用于肺部病灶定位、活检、介入治疗的新技术,其安全性和有效性已得到临床证实。基于机器人支气管镜系统搭载的众多先进技术,临床医生进行气管镜操作时更加智能、方便、稳定,并且较磁导航辅助下支气管镜检查及普通支气管镜检查有更高的准确性、诊断率,并发症也相对较少。本文就机器人支气管镜系统应用的研究进展进行综述,并对其与人工智能领域的结合进行展望。
1 支气管镜发展历史
现代支气管镜的发展与食管镜、喉镜在临床上的应用密不可分。1987 年,有“现代支气管镜之父”之称的德国科学家 Gustav Killian 首先报道了应用喉镜为 1 例男性患者从右主支气管内取出骨性异物的病例,从而开创了气管镜使用的历史[1]。但硬质气管镜存在照明亮度差、视野小、操作时患者较为痛苦、支气管远端难及等问题,在临床上受到一定限制。1962 年,日本胸外科医师 Shigeto Ikeda 意识到光纤成像在支气管镜中的应用前景,着手研究纤维光束支气管镜,于 1964 年研发出纤维支气管镜,随后研究者们在此基础上进一步改良纤维支气管镜,增加镜身 U 型转弯、电视成像系统等,逐步发展为现在所使用的形态[2]。纤维支气管镜的发明称得上是支气管镜发展历史上的第二次革命,使得支气管镜的应用得以飞速发展,临床上支气管镜检查和治疗的适应证也越来越广,气管上绝大多数疾病可以被诊断、缓解甚至治愈,对肺部疾病的诊疗也起到关键性的作用。
支气管镜装置的完善也推动了支气管镜下诊断的发展。1972 年,Andersen 等[3]首先报道了 450 例支气管镜下活检的经验。1978 年,Wang 等[4]发表了首个对气管旁肿瘤行经支气管镜细针穿刺活检(transbronchial needle aspiration,TBNA)的案例。但彼时的 TBNA 存在无法实时引导及可视化的缺陷。1992 年,Hürter 等[5]首次报道了超声支气管镜(endobronchial ultrasound,EBUS)的应用,实现了可经超声探查后经支气管镜肺穿刺活检(EBUS-TBNA)。2004 年,凸面探头的超声支气管镜在纵隔及肺门淋巴穿刺活检中,被证实具有更高的敏感性及特异性,相对于传统的 EBUS,凸面探头超声支气管镜能够实现在超声实时引导下行肿物穿刺,避免穿刺过程中盲穿的情况,并逐步成为诊断肺癌分期的标准检查手段[6-8]。但对于周围型肺部疾病病变,纤维支气管镜有其局限性,难以实现满意的穿刺活检,电磁导航支气管镜(electromagnetic navigational bronchoscopy,ENB)的问世为解决此难题提供了良好方法。2006 年,Schwarz 等[9]首次报道了 ENB 的应用。它是一种将电磁导航系统与现有高清支气管镜系统相结合的新技术,以电磁定位技术为基础,结合高分辨率螺旋 CT 成像与计算机虚拟支气管镜技术,经支气管镜引导至肺部周围型病灶进行活检或治疗[10]。ENB 已经显示出导航的安全性以及对肺部周围型病灶穿刺活检准确性远超传统纤维支气管镜的优点。但其精准度及有效性受支气管镜技术制约,并需要更多的临床实践来证实。同时,对于部分周围型病灶,ENB 往往也难以达到非常满意的活检。并且由于存在呼吸动度的影响,不可避免地出现 CT 虚拟支气管成像与实际患者气管走行及病灶位置存在一定差异。机器人支气管镜系统的发展,则进一步补足相应问题并实现支气管检查更加智能化和更佳的操作性、安全性[11-13]。
2 机器人支气管镜系统介绍
手术机器人的临床应用最早于 1985 年被报道,PUMA 200 机器人系统用于 CT 引导下脑组织活检[14]。在上世纪 90 年代,AESOP 机器人系统(automated endoscopic system for optimal positioning)是美国食品药品监督管理局(FDA)批准的第一个用于手术治疗的机器人手术系统[15-16]。2000 年,FDA 批准达芬奇手术机器人系统用于普外科手术,随后机器人手术系统从普外科[17]逐步应用到泌尿外科、妇科及心胸外科等领域[18]。而专门应用于支气管镜领域的机器人系统目前有 2 种,一种是 Auris Health 公司研发的 Monarch 机器人支气管镜系统,于 2018 年被 FDA 批准上市。另一种是 Intuitive Surgical 公司研发的 Ion 系统,也于 2019 年上市。机器人支气管镜,相对于 ENB 及传统支气管镜,具有更稳定的操纵性,针对周围型病灶取样活检,具有更好的稳定性及精确性。
2.1 Monarch 机器人支气管镜系统
Monarch 机器人支气管镜系统由可伸缩嵌套式支气管镜、机器人臂、显示系统、电磁导航装置及操作手柄组成;见图 1。支气管镜镜身由一个可 130° 活动的关节鞘和一个内部支气管镜组成,镜身可从套筒中伸出并可实现 180° 弯曲,支气管镜外径 4.2 mm,鞘管外径 6 mm,可实现 4 个方向运动。Monarch 机器人支气管镜有 2 个独立的机器人手臂,可以同时或单独操作。遥控装置类似于游戏手柄,可更方便地进行器械操作。支气管镜内含有直径 2.1 mm 的操作通道,可实现径向支气管镜超声检查(radial probe endobronchial ultrasound,R-EBUS)、活检、刷检、吸引等操作。在机器人支气管镜操作过程中,镜身鞘管可以被固定住,内窥镜在磁导航引导下进入气管,依靠磁导航以及气管镜镜头的微型摄像机实现操作的可视化及定位[19]。

图1 Monarch 机器人支气管镜系统
2.2 Ion 机器人支气管镜系统
Ion 机器人支气管镜系统由单个机械手控制的单个支气管镜组成,镜身为超薄机器人导管,导管的外径为 3.5 mm,工作通道为 2.0 mm,可实现镜身 180° 弯曲,使其可以到达肺的所有 18 个节段;见图 2。通过操作装置可控制导管的插入和缩回以及精确的远端尖端关节运动。触摸屏用于在操作过程中更改系统设置。镜身头端置入视觉探头,可以在导航至目标的同时实时观察气管,导管配有光纤形状传感器,每秒可测量导管的完整形状数百次,从而在整个过程中提供实时的精确位置和形状信息。到达肺结节后,可以将导管锁定在适当的位置。形状传感器的实时测量与机器人控制算法相结合,可使导管保持固定,但在组织采样之前必须移除探头,无法实现操作的实时反馈。在活检过程中,Ion 的活检标记功能可以记录活检针的活动轨迹,方便实现多次活检,提高活检准确度[20]。
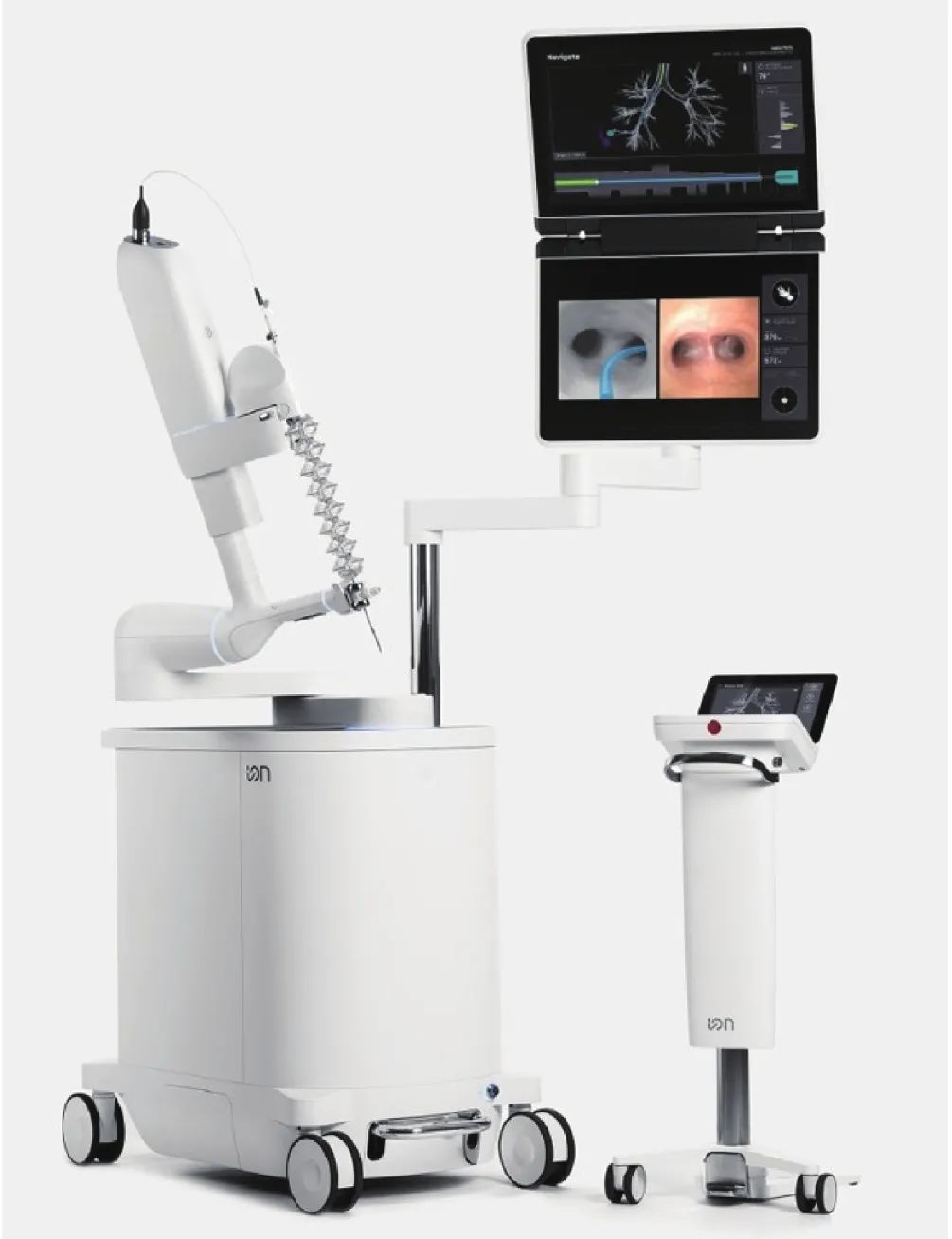
图2 Ion 机器人支气管镜系统
3 机器人支气管镜系统应用现状
3.1 Monarch 机器人支气管镜系统
Rojas-Solano 等[21]首次报道了 Monarch 机器人支气管镜系统的可行性研究,该研究对 15 例肺部病灶患者进行活检(12 例周围型病变,3 例中央型病变),在 14 例(93%)患者中获得了样本,并且没有患者出现气胸或严重出血等并发症。Chaddha 等[22]回顾性分析 Monarch 系统对 165 例患者 167 个肺部病灶导航活检情况,88.6% 的病灶成功导航,其中 70.7% 病灶位于肺外周 1/3,组织样本获取率为 98.8%,诊断率估计为 69.1%~77%。术后 6 例(3.6%)发生气胸,4 例(2.4%)需要放置胸腔引流管,4 例(2.4%)活检后出血。没有呼吸衰竭、死亡或其它任何与手术相关的并发症。Chen 等[23]报道了 Monarch 系统应用于肺周围型病变的一项多中心、前瞻性、可行性研究(BENEFIT 研究),纳入 5 个中心 55 例患者,其中 1 例患者撤回知情同意书,仅 54 例患者纳入分析,其中 53 例患者可获得 R-EBUS 图像。病灶中位直径 23 mm,其中 51 例(51/53,96.2%)成功导航,诊断率为 74.1%,术后 2 例(2/54,3.7%)发生气胸,1 例(1.9%)需行胸腔闭式引流,研究证实了 Monarch 系统相对于传统支气管镜检查,具有高成功率及低不良事件发生率。同时,关于 Monarch 机器人系统的一个更大样本量(1 200 例)囊括 30 个中心的多中心前瞻性研究(TARGET 研究)目前正在进行当中[13]。
3.2 Ion 机器人支气管镜系统
Fielding 等[24]报道了首个 Ion 机器人支气管镜系统的研究,纳入 29 例患者,平均病变大小为 12 mm,其中 28 例(96.6%)成功导航,总体诊断率为 79.3%,恶性肿瘤的诊断率为 88%。Yarmus 等[25]进行了一项前瞻性单盲随机对照研究(PRECISION-1 研究),在人尸体模型上评估了对于<2 cm 的周围型肺结节,用 R-EBUS、磁导航以及 Ion 机器人支气管镜系统进行定位和穿刺目标结节的能力。结果表明,与磁导航相比,使用机器人支气管镜系统的定位和穿刺成功率更高(80% vs. 45%)。目前,关于 Ion 机器人系统的一项多中心、前瞻性研究(PRECIsE 研究)正在进行,该研究纳入 360 例患者,以评估导航和活检的成功率及相关并发症[13]。
3.3 机器人操作系统的局限性
机器人支气管镜系统在良好的安全性基础上,显示其操作的优越性,在导航过程中实时定位、成像,镜身通过机器人平台,可以活动得更加稳定、精准、灵活,实时可视化的活动轨迹可以更准确地进行活检部署,扩大了常规支气管镜的导航及活检范围,肺周围型病灶穿刺定位的成功率及诊断率也较磁导航及普通气管镜高。
但机器人气管镜系统仍存在一定的局限性。Monarch 机器人支气管镜系统镜身外径 4.2 mm,虽然可以通过实时反馈系统进行改善,但一定程度上限制了对部分较细的亚段支气管分支进行非常深入的活检取样。该系统定位依靠磁导航装置,可能会被如起搏器等电磁装置以及金属物品干扰。Ion 系统定位取决于镜身导管中的光纤传感装置,不依赖磁导航,但在穿刺活检过程中缺乏实时视觉反馈,存在位置偏移风险。目前 2 款支气管镜系统均缺乏触觉反馈功能,存在行进过程、操作过程中气管损伤的风险。机器人辅助支气管镜检查目前仍处于起步阶段,治疗成本较高、手术时间较长以及对手术室要求较高也限制了该系统的使用及推广[13]。
4 人工智能在机器人支气管镜系统中的应用展望
目前机器人支气管镜系统应用尚处于起步阶段,机器人系统含有众多高科技技术成分,基于此先进系统,人工智能辅助在该系统中的应用将有广阔前景,包括肺周围型病灶一体化诊疗模式、肺结节手术路径最优化建议等,希望在后续的机器人系统中得以实现。
4.1 肺周围型结节处理多模式规划
在已报道的研究[26]中,机器人辅助下支气管镜对肺部病灶的导航成功率在 88%~96%,诊断率在 69%~79%。在机器人支气管镜系统下,肺周围型病灶治疗策略可以进行智能化、一站式分析及治疗。快速现场病理评估(ROSE)的应用,使得很大一部分肺结节病灶得以现场诊断。对于可手术病灶,可通过注射吲哚菁绿,或人工智能轨迹识别进行精准定位,引导手术精准切除。对于不可手术病灶,可进行视觉引导下的支气管镜消融治疗,例如光动力疗法治疗、微波消融、射频消融、激光间隙热疗、冷冻消融和支气管镜热蒸汽消融等,进而实现肺周围型病灶的一站式精准治疗[12]。
4.2 肺结节治疗路径最优化建议
肺结节治疗路径最优化建议也是本中心对未来肺结节治疗的一种思路,我们希望利用人工智能大数据,在综合患者年龄、性别、吸烟史、肺功能、手术史、肺部病灶大小、数量、观察时间等一系列因素基础上,对于不同数目、位置、大小、密度的肺结节,智能、合理地规划最优的治疗建议。对需要手术治疗病例,合理规划手术方式、手术路径;如需要杂交治疗,制定手术+内镜介入治疗方案。对不适合手术治疗病例,制定合理的介入治疗方式。实现肺结节疾病的综合、全面、一站式智能化治疗。
5 小结
机器人支气管镜系统目前尚在起步阶段,其安全性、有效性已得到证实,与磁导航辅助下支气管镜检查及普通支气管镜检查相比,有更高的准确性、诊断率,并发症也相对较少。然而目前尚缺乏大样本临床验证,需要更多的临床数据来支持推广。但机器人支气管镜系统已显示出其优势,在肺部病灶的综合化治疗上更有特点。我们希望该系统在胸科领域得以进一步临床推广,进一步结合人工智能,让机器人更加“智能化”,对胸科疾病的诊断、治疗提供更多的帮助。
【来源】中国胸心血管外科临床杂志 作者倪彭智等
【声明】部分文章和信息来源于互联网,不代表本订阅号赞同其观点和对其真实性负责。如转载内容涉及版权等问题,请立即与我们联系,我们将迅速采取适当措施。