您现在的位置:
首页>
新闻中心>首个“进口转本土”医疗器械诞生,审评周期缩短50%
首个“进口转本土”医疗器械诞生,审评周期缩短50%
发布时间:2021/4/23 15:55:21
首个“进口转本土”医疗器械诞生,审评周期缩短50%
上海市首个“进口医疗器械产品在中国境内企业生产”的第二类医疗器械产品诞生。
“对我们来说真是很大的惊喜!”今天(3月30日),在上海市药品监督管理局业务大厅,前来“领证”的飞利浦中国政府事务总监周斐欣喜地与记者交流:受益于这份“惊喜”,大大加速了飞利浦在中国的产业链布局,“至少提速一年!”
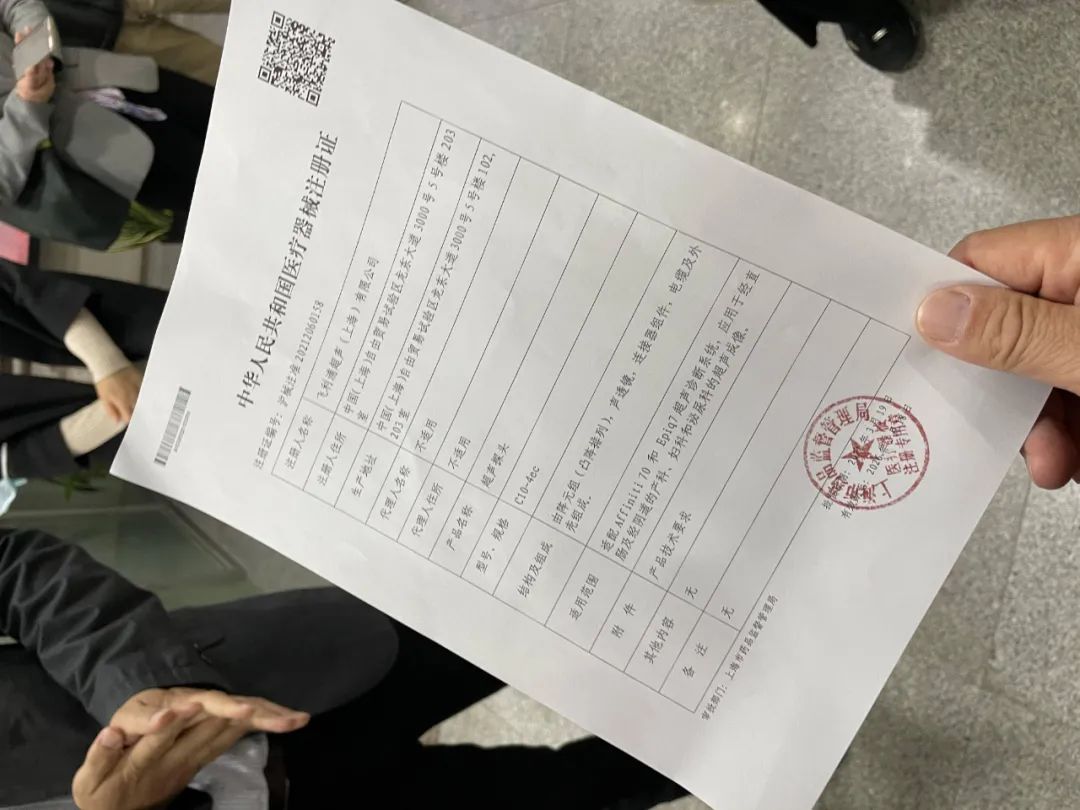
3月15日,上海市医疗器械化妆品审评核查中心完成了上海市首个“进口医疗器械产品在中国境内企业生产”的第二类医疗器械产品“超声探头”的技术审评。该产品为飞利浦(中国)投资有限公司的进口医疗器械产品转化,由其在国内的子公司飞利浦超声(上海)有限公司申请国内注册。这一“超声探头”顺利通过技术审评,标志着“进口转本土”政策在上海市的平稳落地,其背后的惠企、惠民意义颇受业内关注。“转产”成功第一例 一举实现3大“本土化”突破中国市场,早已成为全球市场不愿意错过的热土,重要性不言而喻。记者了解到,飞利浦近年来有意愿向中国转移更多产能,这个“愿望”恰逢一条新政落地。就在2020年9月25日,国家药监局发布《国家药监局关于进口医疗器械产品在中国境内企业生产有关事项的公告》(2020年第104号),业内简称“104号文”。业内分析,近年来,业界对进口医疗器械产品在中国境内企业生产,优化有关注册申报资料、避免注册申报资料重复提交的要求的诉求不断增加,为落实党中央、国务院深化“放管服”改革和优化营商环境要求,深化医疗器械审评审批制度改革,2019年以来,国家药监局经深入调研,充分听取各方面意见后,“104号”文件出炉。这到底能带来什么?上海市药监局副局长郭术廷告诉记者,针对注册申报材料重复提交等问题,“104号文”明确了包括注册检测试验、临床试验等在内的四大类“资料豁免”。“这对进口医疗器械实现本土化生产意义非凡。以临床试验为例,进口医疗器械原本要转境内生产,要重新启动本土临床试验,从设计临床试验到医院招募临床试验受试者、总结数据等,这个过程起码半年以上。”飞利浦超声(上海)有限公司注册法规经理韦凯说。对企业而言,时间成本与实打实的效益成本甚至市场占有格局息息相关。“104号文”落地,让飞利浦走上了一条全新的审评审批“快车道”:飞利浦的这款“超声探头”于2020年11月13日受理,2021年3月15日完成技术审评,审评总时限122个自然日,比传统平均审评周期缩短50%!经审评核查确认,该产品一举实现了3大“本土化”突破:一是主要生产工艺本土化,对产品性能起决定性作用的陶瓷阵元加工过程全部在国内完成;二是主要原材料供应本土化,产品主要原料“陶瓷片”突破技术瓶颈,避免进口零部件的高关税负担;三是尖端生产检验设备本土化,陶瓷片加工的数字化程序控制设备和阻抗、隔离、极性、气压等自动化检测设备国内已有配备。“上海服务”建审评服务新路径 持续改革创新放大“首例”效应上海首个“进口转本土”产品诞生具有标志性意义,通过该案例,市器审中心明确了该类产品的申报资料要求、审评要点,为符合条件的产品申报打通了审评路径,大大节省了企业设计开发验证、资料重复提交的成本和时间。飞利浦特地致信上海市药监局,表达感谢:“市器审中心提供了优质高效的服务,大大加速了产品的上市速度,有效降低企业运营负担,对落实进口产品加速本地生产的战略具有极其重要的意义。”一个国家新政落地,需要地方“服务配套”。记者从市药监局获悉,2020年9月25日,国家药监局“104号文”落地,上海市器审中心立即组织专题组深入研究政策精髓,严谨把握使用范围,及时开展有效的审评路径探索工作,在“标准不降低”的前提下,着力简化注册资料,优化审评流程。

“在收到飞利浦超声(上海)有限公司关于超声探头的注册申请后,迅速安排医疗器械注册部、体系部专人对接,全程指导。”郭术廷告诉记者,这包括产品申报前,提前沟通企业产品设计、性能要求、临床应用范围等技术问题,仔细审核原注册进口产品的相关资料,核实产品的一致性;现场检查时,医疗器械重点关注国内外质量管理体系的等同性、溯源性,充分解读国内外标准的差异;检查结束后,建立专题微信群对接企业指导后续整改工作等。成功领到上海“第一证”,也加速了飞利浦整个中国超声业务的产业链布局。记者还获悉,飞利浦这款“超声探头”在中国有不少伙伴企业,此次加速的本土化生产进程对其所在的产业链亦价值非凡。而这些“省下”的成本最终将转化会给老百姓的福利,有望以更快时间、更低价格享受到更优质的医疗器械。“104号文”的“红利”已吸引不少企业的目光。波士顿科学质量总监许斌告诉记者,波科眼下手持300多个进口器械注册证,如果走“进口转本土”审评路径,对企业、对进口产品尽早辐射中国患者这件事,都是非常有利的,因此对国家药监新政对上海药监局的创新服务都非常期待。市药监局表示,市器审中心将继续贯彻落实党中央、国务院深化“放管服”改革和优化营商环境要求,深化医疗器械审评审批制度改革,深入理解科学监管内涵,在风险可控的基础上积极探索创新审评模式,鼓励进口医疗器械本土化的生产进程,降低诊疗成本,满足公众临床需要。
来源:器械注册里外事
【本文内容为转载,我公司不对本文所包含内容的准确性、可靠性或者完整性提供任何明示或暗示的保证,不对本文观点负责。如转载内容涉及版权等问题,请立即与我们联系,我们将迅速采取适当措施,以保障双方权益,谢谢。】